Презентация на тему: Цинк

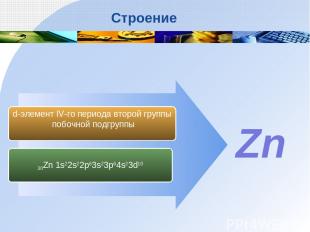
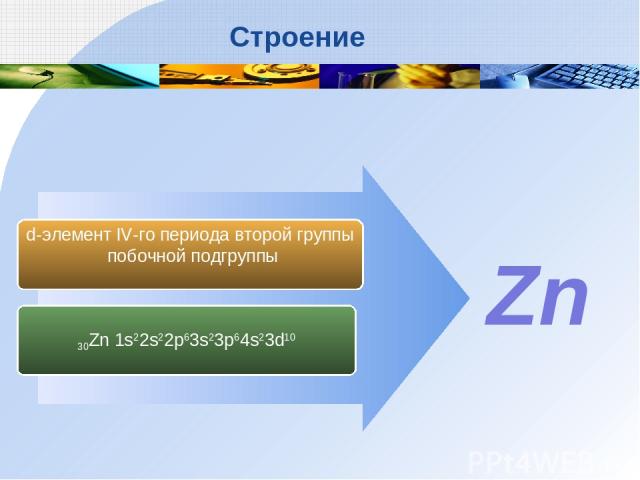
30Zn 1s22s22p63s23p64s23d10 d-элемент IV-го периода второй группы побочной подгруппы Zn Строение

Нахождение в природе По содержанию в земной коре цинк занимает 23-место среди других элементов (0,01%). Обычно цинковые руды – полиметаллические. Они содержат минералы меди, свинца, кадмия и др. Важнейший минерал цинка – цинковая обманка ZnS – входит в состав многих сульфидных руд. Также встречаются: ZnO-цинкит ZnCO3(галмей)-цинковый шпат Основные месторождения полиметаллических цинковых руд расположены в Жезказганской области, на Рудном Алтае и в Южном Казахстане. Металлургические заводы выпускающие цинк Риддер,Шымкент Усть-Каменогорск

Получение 1)Пирометаллургический способ: 2 ZnS+ 3O2 = 2 ZnO + SO2 ZnO + C = Zn + CO 2)Гидрометаллургический способ: ZnO + H2SO4 = ZnSO4 + H2O Конечный продукт очищается от примесей (Fe,Cu,Cd), и цинк выделяется электролизом, причем H2SO4 регенерируется: 2 ZnSO4 + 2 H2O = 2 Zn + 2 H2SO4 + O2

Физические свойства Является амфотерным металлом. Цвет – синевато-белый, имеет сильный металлический блеск. Плотность – 7,13 г/см3 Довольно пластичен, но при обычной температуре является хрупким. Т(плав)=419,4 С Т(кип)=905,7 С Теплопроводность – составляет 60% от теплопроводности серебра, а электрическая проводимость в 4 раза меньше.

Химические свойства При взаимодействии с О2 – окисляется (покрывается оксидной пленкой) Взаимодействует с простыми веществами (с галогенами). Взаимодействие со сложными веществами (с кислотами, щелочами, водой)

Взаимодействие цинка с простыми веществами 2Zn + O2 2ZnO Zn + S ZnS Zn + СI2 ZnCI2 3Zn + 2P Zn3P2
![Zn + 2NaOH + 2H2O Na2 [Zn(OH)4] + H2 Zn + H3PO4 ZnHPO4 + H2 Zn + 4HNO3(конц.) Zn Zn + 2NaOH + 2H2O Na2 [Zn(OH)4] + H2 Zn + H3PO4 ZnHPO4 + H2 Zn + 4HNO3(конц.) Zn](https://fs3.ppt4web.ru/images/132073/184177/310/img7.jpg)
Zn + 2NaOH + 2H2O Na2 [Zn(OH)4] + H2 Zn + H3PO4 ZnHPO4 + H2 Zn + 4HNO3(конц.) Zn(NO3)2 + 2NO2 + 2H2O 4Zn + 10HNO3(разб.) 4Zn(NO3)2 + NH4NO3 + +3H2O

Применение Как антикоррозийное покрытие. Изготовление гальванических элементов. Как восстановитель в гидрометаллургических процессах способствующих извлечению многих ценных металлов из растворов Ag, Au, Cd и т.д. Получение сплавов: латунь(30%) – сплав Cu и различное содержание цинка. нейзильберы(22%) – “новое серебро”
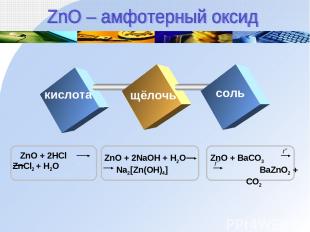
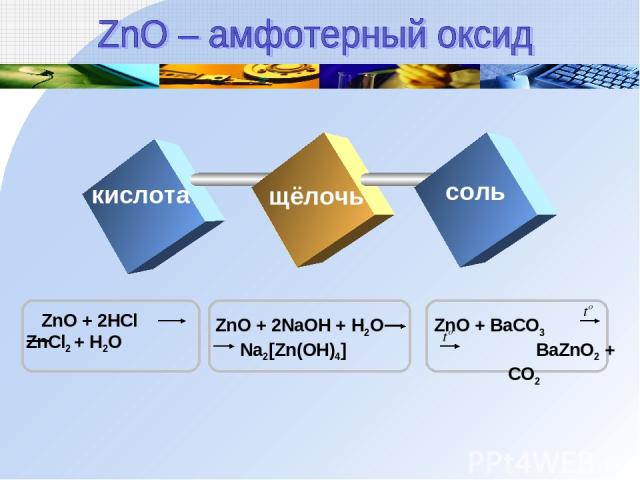
кислота щёлочь соль
![Zn(OH)2 + 2HCl ZnCl2 + 2H2O Zn(OH)2 ZnO + H2O Zn(OH)2 + 2NaOH Na2[Zn(OH)4] кисло Zn(OH)2 + 2HCl ZnCl2 + 2H2O Zn(OH)2 ZnO + H2O Zn(OH)2 + 2NaOH Na2[Zn(OH)4] кисло](https://fs3.ppt4web.ru/images/132073/184177/310/img10.jpg)
Zn(OH)2 + 2HCl ZnCl2 + 2H2O Zn(OH)2 ZnO + H2O Zn(OH)2 + 2NaOH Na2[Zn(OH)4] кислота Text щелочь t0 t0








![Zn + 2NaOH + 2H2O Na2 [Zn(OH)4] + H2 Zn + H3PO4 ZnHPO4 + H2 Zn + 4HNO3(конц.) Zn(NO3)2 + 2NO2 + 2H2O 4Zn + 10HNO3(разб.) 4Zn(NO3)2 + NH4NO3 + +3H2O Zn + 2NaOH + 2H2O Na2 [Zn(OH)4] + H2 Zn + H3PO4 ZnHPO4 + H2 Zn + 4HNO3(конц.) Zn(NO3)2 + 2NO2 + 2H2O 4Zn + 10HNO3(разб.) 4Zn(NO3)2 + NH4NO3 + +3H2O](https://fs3.ppt4web.ru/images/132073/184177/640/img7.jpg)

![Zn(OH)2 + 2HCl ZnCl2 + 2H2O Zn(OH)2 ZnO + H2O Zn(OH)2 + 2NaOH Na2[Zn(OH)4] кислота Text щелочь t0 t0 Zn(OH)2 + 2HCl ZnCl2 + 2H2O Zn(OH)2 ZnO + H2O Zn(OH)2 + 2NaOH Na2[Zn(OH)4] кислота Text щелочь t0 t0](https://fs3.ppt4web.ru/images/132073/184177/640/img10.jpg)












