Презентация на тему: Теория электролитической диссоциации

Теория электролитической диссоциации(обобщающий урок)

Сванте Аррениус Шведский ученый, лауреат Нобелевской премии мира по химии в 1903 году. Автор теории электролитической диссоциации в 1887 году.

Основные положения ТЭД 1. При растворении в воде электролиты диссоциируют (распадаются) на положи-тельные и отрицательные ионы. 2. Причиной диссоциации электролита в водном растворе является его гидра-тация, т.е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем.3. Под действием электрического тока положительно заряженные ионы (кати-оны) движутся к катоду, а отрицательно заряженные ионы(анионы) движутся к аноду.

Степень электролитической диссоциации Обозначается (альфа)Измеряется в % (долях) - число частиц, распавшихся на ионы (диссоциированных) - общее число частиц , введенных в раствор

СИЛЬНЫЕ И СЛАБЫЕ ЭЛЕКТРОЛИТЫ
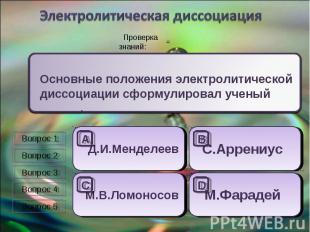
Электролитическая диссоциация Основные положения электролитической диссоциации сформулировал ученый ______.

Электролиз Электролиз — процесс, протекающий на электродах при прохождении электри-ческого тока через раствор либо расплав электролита.

Электролиз Электролиз является одним из способов промышленного получения алюми-ния, водорода, хлора, хлорорганических соединений, диоксида марганца и др. Большое количество металлов извлекаются из руд и подвергаются переработке с по-мощью электролиза. Электролиз находит применение в очистке сточных вод.

Законы Фарадея В 1832 году Фарадей установил, что масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит: (22.09. 1791 — 25.08.1867)—англий-ский физик, химик, основоположник учения об электромагнитном поле.

Гальванический элемент Гальванический элемент — химический источник электрического тока, наз-ванный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к воз-никновению в замкнутой цепи электрического тока.


Багдадские батарейки Багдадские батарейки - ряд артефактов, найденных на территории Месопотамии, которые датируются первыми столетиями нашей эры. Когда археологи наткнулись на батарейки, то предположили, что это обычные глиняные горшки для хранения, но эта теория сразу же отпала, так как каждая из них содержала медный прут со следами кислотной коррозии. Багдадская батарейка, заполненная кислотой или щёлочью, могла создать электрический ток напряжением в один вольт.

Батареи, возможно, использовались, чтобы наносить гальваническое покрытие из золота на статуэтки и другие изделия. К примеру, в Багдадском музее имеются посеребренные вазы, датированные 2500 г. до н.э., серебро на вазы было нанесено электролитическим методом.

Профессор Дж. Б. Перчински из Уни-верситета Север-ной Каролины соз-дал точную копию «батарейки» и на-полнил её пятипро-центным винным уксусом. Было за-фиксировано на-пряжение в 0,5 вольта.

Простейшая гальваническая ванна

Гальваника
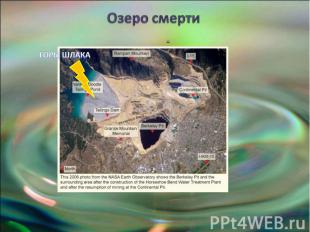
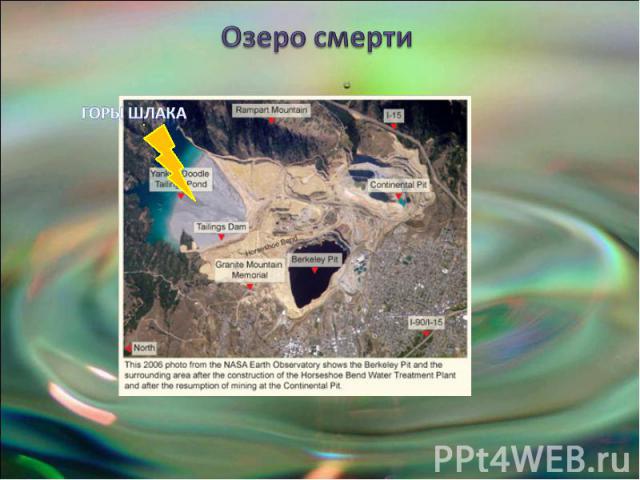
Озеро смерти

Озеро Беркли-Пит И это Беркли Пит — озеро, нахо-дящееся в большой яме старого медного рудника около города Бьютт, штат Монтана, США. Это озеро считается самым токсич-ным в мире.Медь, кислоты, цинк, мышьяк - самая ядо-витая часть таблицы Менделеева сосредо-точена в одном месте.С 1864 по 1982 год месторождение активно раз-рабатывалось, подземное пространство здесь повсюду прорезано тоннелями общей протя-жённостью 16 тысяч км. В 1955 на шахте на-чали открыто добывать руду и железо.В 1982 году рудник перестал работать. Насосы, которые откачивали подземные воды демонти-ровали, и вскоре карьер затопило. Сегодня объём озера 150 млрд литров, каждый день ту-да ещё просачивается 10 млн. литров.

Что происходит в озере смерти? При соприкосновении воды с срезами скальных пород в заброшенной шахте про-изошла цепь химических реакций, и при то что медной руды было слишком мало, чтобы окупить дальнейшую разработку месторождения, её оказалось достаточно, чтобы создать определённые экологические последствия.В скальных породах в виде сульфидов лежат медь, железо, и другие металлы. В основном преобладает пирит (соединение серы и железа), вступающий в ре-акцию с кислородом и водой, в результате чего образуется серная кислота (H2 SO4) и свободные ионы железа. От переизбытка высвобождаемого железа озеро имеет оранжевый оттенок.Кроме того, ионы железа вступают в реакцию с другими сульфидами металлов, в результате чего из скальных пород в больших количествах высвобождается це-лый букет металлов: мышьяк( надо знать что это полуметалл), кадмий, свинец , магний , марганец и цинк.

Благодарим за внимание!