Презентация на тему: Первый закон термодинамики


Изучить закон сохранения энергии, распространённый на тепловые явления – первый закон термодинамики. Рассмотреть изопроцессы в газах с энергетической точки зрения, примененив к ним первый закон термодинамики. Дать понятие адиабатического процесса. Цели

Фронтальный опрос 1. Дать определение внутренней энергии. 2.Что называют количеством теплоты? Повторение 3 .Что называют вечным двигателем первого рода ?

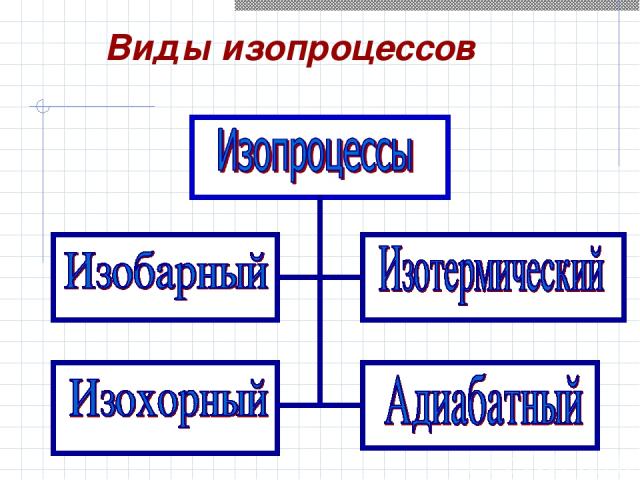
Содержание 1-ого закона термодинамики Применение 1-ого закона термодинамики к изопроцессам в газах Адиабатический процесс Необратимость процессов в природе План урока
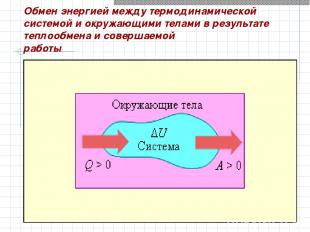
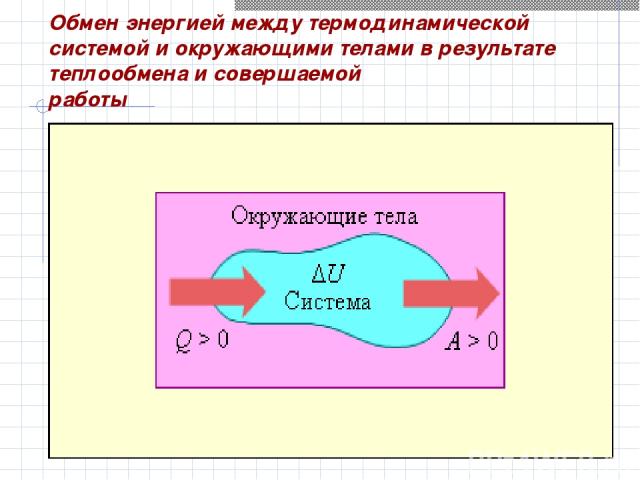
Обмен энергией между термодинамической системой и окружающими телами в результате теплообмена и совершаемой работы

Изменение Δ U внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы A внешних сил и количества теплоты Q, переданного системе Первый закон термодинамики ΔU = Q + A

Q = ΔU + A’ Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами. Вторая запись первого закона термодинамики
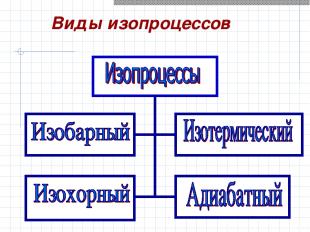
Виды изопроцессов
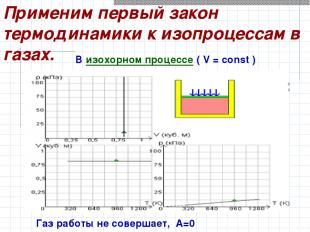
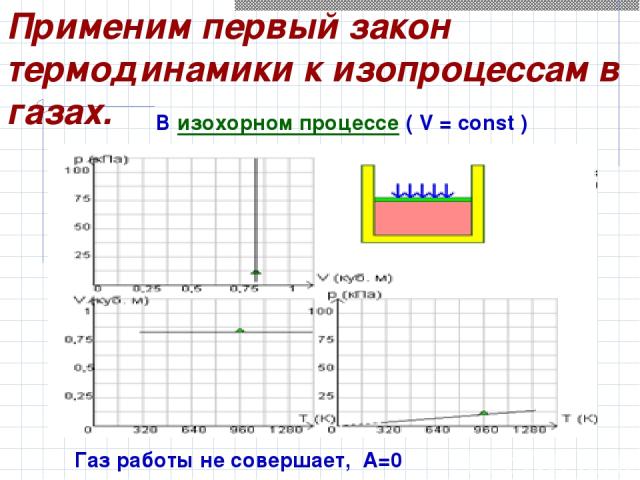
Применим первый закон термодинамики к изопроцессам в газах. В изохорном процессе ( V = const ) Газ работы не совершает, А=0

Здесь U (T1) и U (T2) – внутренние энергии газа в начальном и конечном состояниях. Q = ΔU = U (T2) – U (T1) Первый закон термодинамики для изохорного процесса
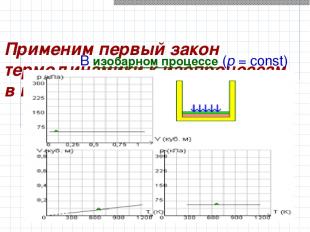
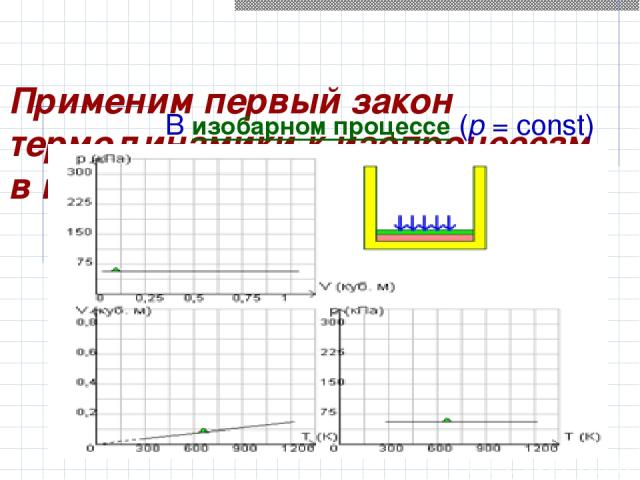
Применим первый закон термодинамики к изопроцессам в газах. В изобарном процессе (p = const)

Работа, совершаемая газом, выражается соотношением A = p (V2 – V1) = p ΔV p-давление V1,V2- объем в начальном и конечном состояниях соответственно

Применим первый закон термодинамики к изопроцессам в газах. Первый закон термодинамики для изобарного процесса : Q = U (T2) – U (T1) + p (V2 – V1) = ΔU + p ΔV
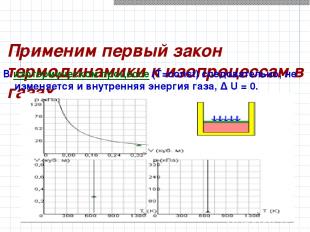
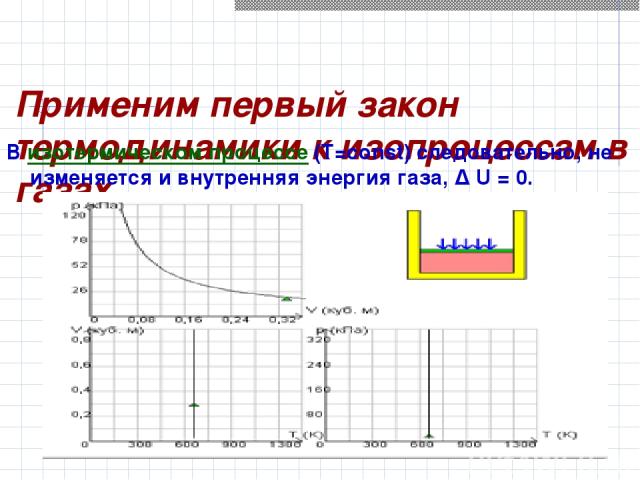
Применим первый закон термодинамики к изопроцессам в газах. В изотермическом процессе (T=const) следовательно, не изменяется и внутренняя энергия газа, Δ U = 0.

Первый закон термодинамики для изотермического процесса выражается соотношением Q = A Количество теплоты Q, полученной газом в процессе изотермического расширения, превращается в работу над внешними телами.
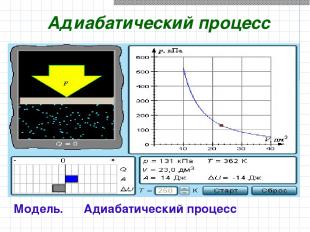
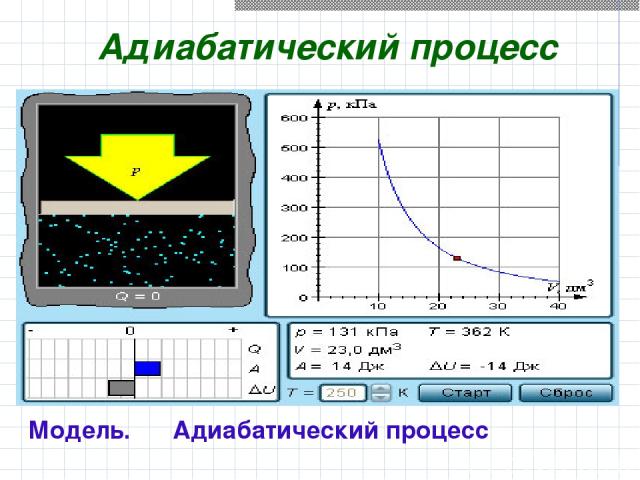
Адиабатический процесс Модель. Адиабатический процесс

В адиабатическом процессе Q = 0; поэтому первый закон термодинамики принимает вид газ совершает работу за счет убыли его внутренней энергии. A = –ΔU
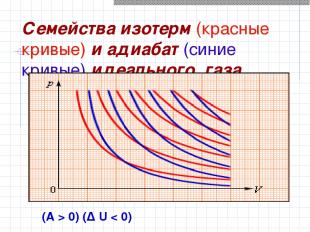
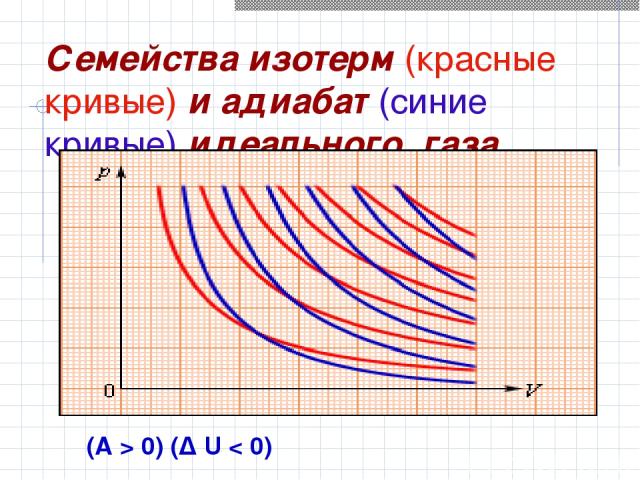
Семейства изотерм (красные кривые) и адиабат (синие кривые) идеального газа (A > 0) (Δ U

Работа газа в адиабатическом процессе просто выражается через температуры T 1 и T 2 начального и конечного состояний A = CV (T2 – T1)
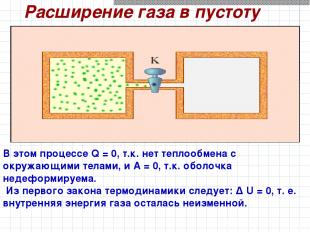
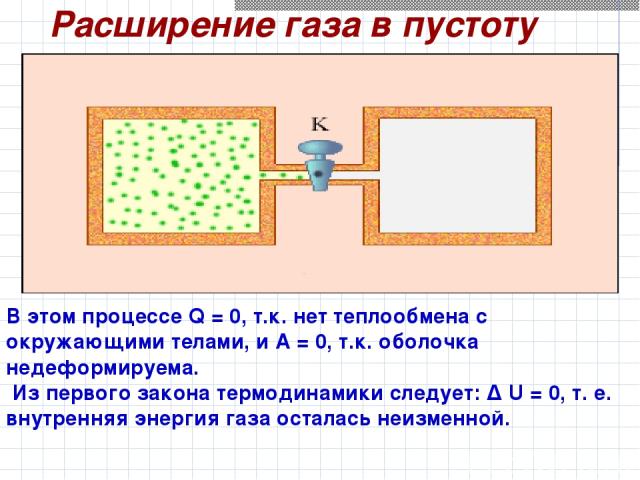
Расширение газа в пустоту В этом процессе Q = 0, т.к. нет теплообмена с окружающими телами, и A = 0, т.к. оболочка недеформируема. Из первого закона термодинамики следует: Δ U = 0, т. е. внутренняя энергия газа осталась неизменной.
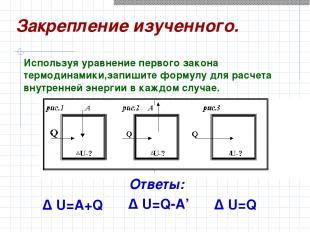
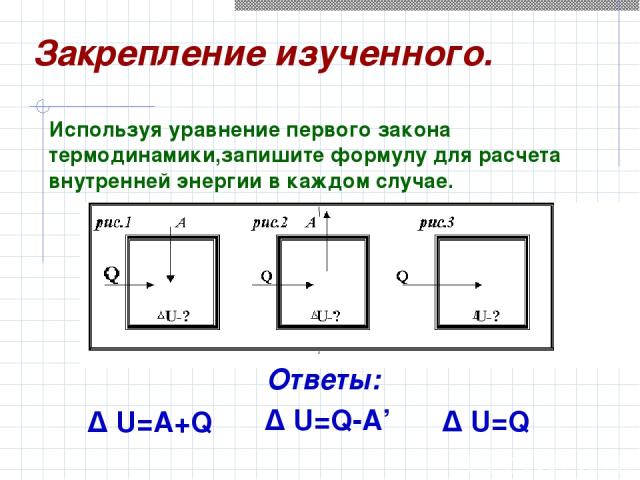
Δ U=A+Q Δ U=Q Δ U=Q-A’ Используя уравнение первого закона термодинамики,запишите формулу для расчета внутренней энергии в каждом случае. Закрепление изученного. Ответы:
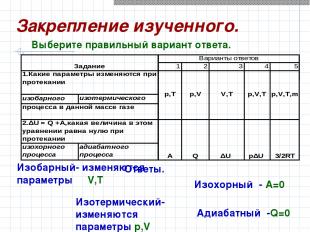
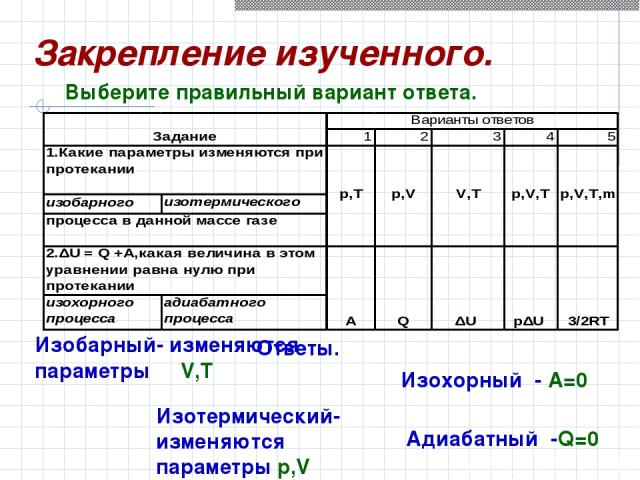
Ответы. Изобарный- изменяются параметры V,T Изотермический-изменяются параметры p,V Изохорный - A=0 Адиабатный -Q=0 Выберите правильный вариант ответа. Закрепление изученного.

Список использованных источников 1. Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Сотский «ФИЗИКА 10», Москва, « Просвещение» , 2010 г.