Презентация на тему: Основы термодинамики необратимых процессов

Основы термодинамики необратимых процессов
Термодинамическая система – совокупность тел, способных энергетически взаимодействовать между собой и с другими телами и обмениваться с ними веществом и энергией. Все тела вне указанной совокупности представляют собой внешнюю среду. Основные понятия термодинамики
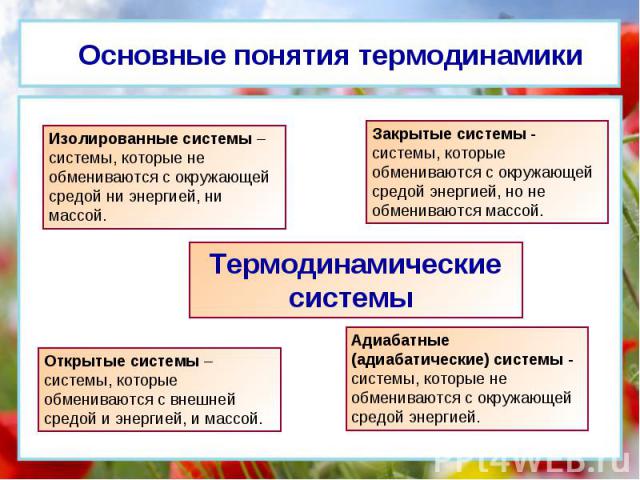
Основные понятия термодинамики Изолированные системы – системы, которые не обмениваются с окружающей средой ни энергией, ни массой. Закрытые системы - системы, которые обмениваются с окружающей средой энергией, но не обмениваются массой. Открытые системы – системы, которые обмениваются с внешней средой и энергией, и массой. Адиабатные (адиабатические) системы - системы, которые не обмениваются с окружающей средой энергией. Термодинамические системы

Основные понятия термодинамики Экстенсивные параметры – характеризуют систему как целое. Это масса и пропорциональные ей величины, например – объем. Эти величины имеют аддитивный характер – общая масса системы равна сумме масс ее отдельных частей и т.п. Интенсивные параметры – не зависят от массы и могут принимать вполне определенные значения в каждой точке системы. Термодинамические параметры величины, характеризующие состояние термодинамической системы.

Основные понятия термодинамики Равновесный процесс – процесс, рассматриваемый как непрерывный ряд равновесных состояний системы. Обратимый термодинамический процесс – процесс, после которого система и взаимодействующие с ней системы могут возвратиться в начальное состояние. Термодинамический процесс изменение состояния системы, которое характеризуется изменением ее термодинамических параметров Равновесный процесс всегда обратим, а обратимый процесс всегда протекает равновесным путем.

Равновесное состояние системы – состояние, в которое со временем приходит система при постоянных внешних условиях, и которое характеризуется неизменностью во времени термодинамических параметров и отсутствием в системе потоков вещества и теплоты. Постоянство параметров не должно быть связано с протеканием какого-либо процесса, внешнего по отношению к системе. Основные понятия термодинамики

Описание эволюции системы во времени и свойств таких систем термодинамика неравновесных процессов

Н. М. Бажин, В. А. Иванченко, В. Н. Пармон. Термодинамика для химиков. М.: Химия, КолосС, 2004 – 416 с. Литература:

Современная термодинамика / Пригожин И., Кондепуди Д. – М.: Мир, 2002. – 462 с. Литература:

Пригожин И. Введение в термодинамику необратимых процессов. – Ижевск: НИЦ «Регулярная и хаотическая динамика», 2001. – 160с. Литература:

Агеев Е.П. Неравновесная термодинамика в вопросах и ответах. М.: Эдиториал УРСС, 2001. – 136 с. Литература:

Journal of Non-Equilibrium Thermodynamics http://www.degruyter.com/view/j/jnet 4 Issues per yearIMPACT FACTOR 2010: 1.152 Научная периодика

The Journal of Chemical Thermodynamics Impact Factor: 2.794 http://www.journals.elsevier.com Научная периодика

Системы в термодинамике неравновесных процессов Типы неравновесных систем Постулаты термодинамики необратимых процессов Локальные величины в неравновесной термодинамике Изменение энтропии в открытой системе Производство энтропии для однородной гомогенной системы при наличии химических превращений
Термодинамическая система – совокупность тел, способных энергетически взаимодействовать между собой и с другими телами и обмениваться с ними веществом и энергией. Все тела вне указанной совокупности представляют собой внешнюю среду. Системы в термодинамике неравновесных процессов

Системы в термодинамике неравновесных процессов Для неравновесных систем (открытых и закрытых) характерны неравновесные состояния, параметры и свойства которых являются функциями времени и/или пространства. В общем случае неравновесную систему нельзя охарактеризовать едиными значениями Т и р.

Однородное состояние Стационарное состояние Неоднородное и нестационарное состояние Равновесное состояние fi - cвойство системы

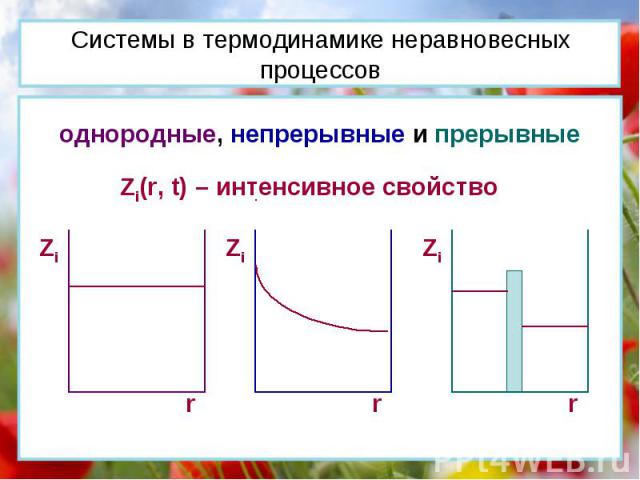
Системы в термодинамике неравновесных процессов однородные, непрерывные и прерывные Zi(r, t) – интенсивное свойство Zi r Zi r Zi r
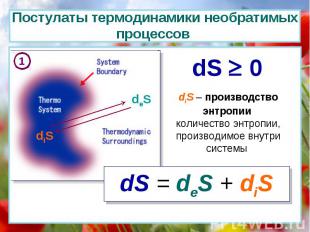
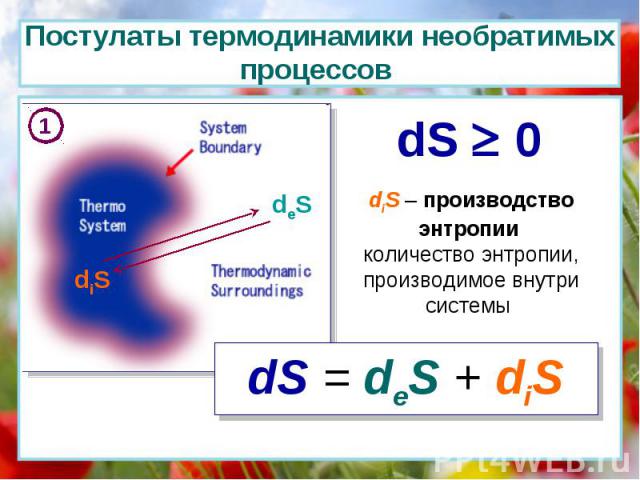
diS deS dS 0 diS – производство энтропии количество энтропии, производимое внутри системы dS = deS + diS 1 Постулаты термодинамики необратимых процессов

Постулаты термодинамики необратимых процессов 2 энтропия вне равновесия зависит от тех же величин и переменных, что и в состоянии равновесия (допущение существования локального равновесия) diS 0
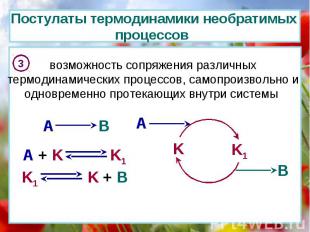
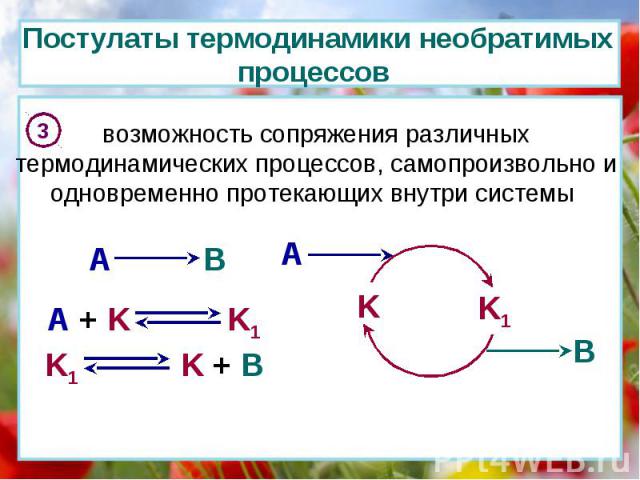
Постулаты термодинамики необратимых процессов 3 возможность сопряжения различных термодинамических процессов, самопроизвольно и одновременно протекающих внутри системы A B K K1 A B A + K K1 K1 K + B

принципиальная важность понятия устойчивости неравновесной системы Постулаты термодинамики необратимых процессов 4

Локальные макроскопические величины – величины, отнесенные к физически бесконечно малым частям системы Физически бесконечно малая величина – конечная, но относительно малая часть целого. Применимо только для экстенсивных величин. Физически бесконечно малый объем должен быть велик по сравнению с расстоянием между молекулами и очень мал по сравнению с макроскопическими неоднородностями среды. Локальные величины в неравновесной термодинамике

Локальное термодинамическое равновесие - термодинамическое равновесие, которое реализуется только в физически бесконечно малых частях системы. При этом макроскопические величины, характеризующие систему в целом, становятся функциями координат и времени. Время установления локального равновесия составляет порядка 1,6*10-10 с для газов и 1*10-13 с для жидкостей Локальные величины в неравновесной термодинамике
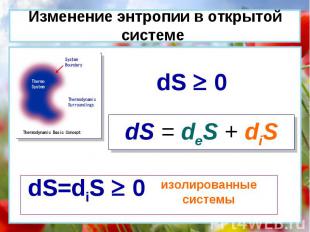
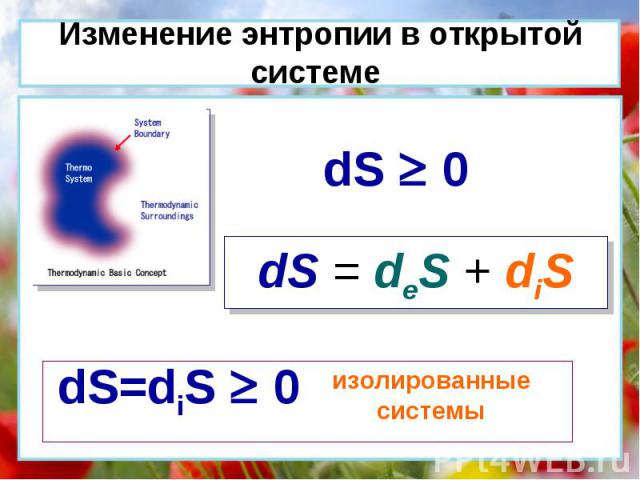
dS = deS + diS dS 0 dS=diS 0 изолированные системы Изменение энтропии в открытой системе

dS = deS + diS dS/dt = deS/dt + diS/dt Скорость общего изменения энтропии dS/dt системы равна сумме скорости возникновения (производства) энтропии внутри самой системы diS/dt и скорости обмена энтропией между системой и окружающей средой deS/dt Изменение энтропии в открытой системе

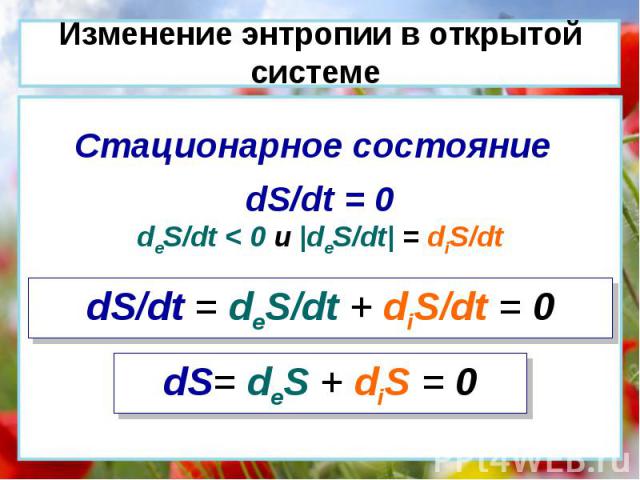
dS/dt = deS/dt + diS/dt 1. dS/dt > 0 deS/dt > 0 или deS/dt < 0, но |deS/dt| < diS/dt 2. dS/dt < 0 deS/dt < 0 и |deS/dt| > diS/dt 3. dS/dt = 0 deS/dt < 0 и |deS/dt| = diS/dt Изменение энтропии в открытой системе

dS/dt = deS/dt + diS/dt = 0 dS/dt = 0 deS/dt < 0 и |deS/dt| = diS/dt Стационарное состояние dS= deS + diS = 0 Изменение энтропии в открытой системе
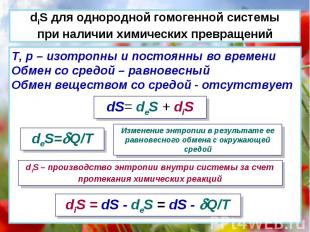
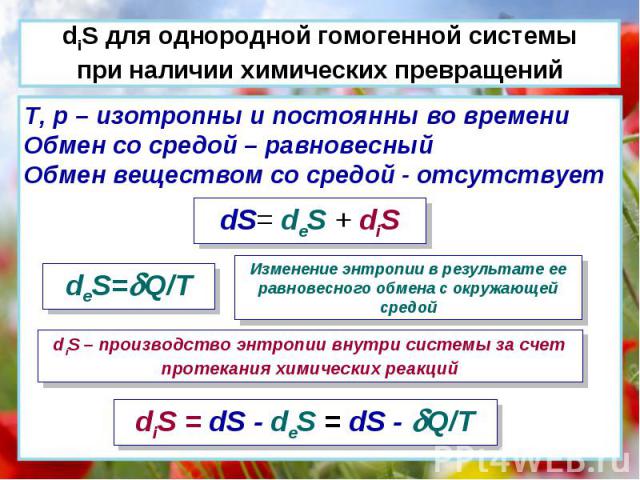
T, p – изотропны и постоянны во времени Обмен со средой – равновесный Обмен веществом со средой - отсутствует dS= deS + diS deS=Q/T Изменение энтропии в результате ее равновесного обмена с окружающей средой diS – производство энтропии внутри системы за счет протекания химических реакций diS = dS - deS = dS - Q/T diS для однородной гомогенной системы при наличии химических превращений

Система совершает только механическую работу расширения Q = dU + PdV diS = dS – (dU + PdV)/T diS = (1/T)(TdS – dU - PdV) dG = -TdS + dU + PdV diS = -dG/T > 0 diS для однородной гомогенной системы при наличии химических превращений

diS = -dG/T > 0 σ diS/dt = -(1/T)(dG/dt) > 0 Скорость производства энтропии в открытой системе при постоянных Т и р пропорциональна скорости уменьшения термодинамического потенциала Гиббса системы diS для однородной гомогенной системы при наличии химических превращений