Презентация на тему: Фазовый переход пар — жидкость

Фазовый переход пар — жидкость

Любое вещество при определенных условиях может находиться в различных агрегатных состояниях – твердом, жидком и газообразном. Переход из одного состояния в другое называется фазовым переходом. Испарение и конденсация являются примерами фазовых переходов.Все реальные газы (кислород, азот, водород и т. д.) при определенных условиях способны превращаться в жидкость. Однако такое превращение может происходить только при температурах ниже определенной, так называемой критической температуры Tкр. Например, для воды критическая температура равна 647,3 К, для азота 126 К, для кислорода 154,3 К. При комнатной температуре (? 300 К) вода может находиться и в жидком, и в газообразном состояниях, а азот и кислород существуют только в виде газов.
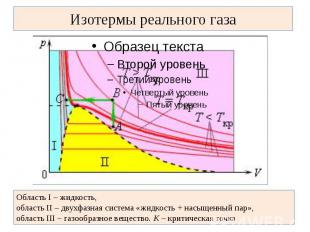
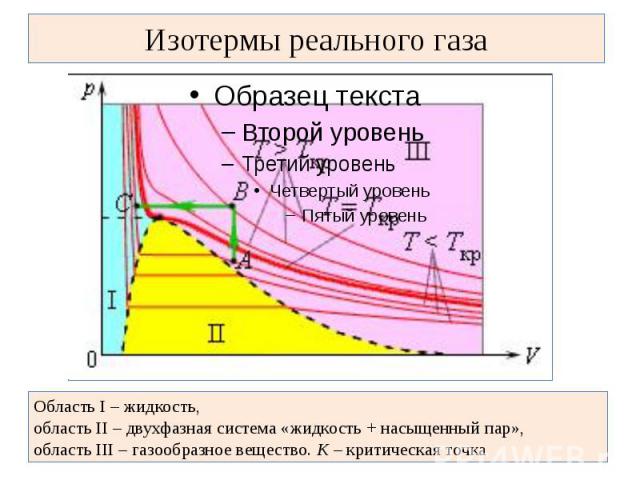
Изотермы реального газа Область I – жидкость, область II – двухфазная система «жидкость + насыщенный пар», область III – газообразное вещество. K – критическая точка

В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара. Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного пара p0 данного вещества зависит только от его температуры и не зависит от объема. Поэтому изотермы реальных газов на плоскости (p, V) содержат горизонтальные участки, соответствующие двухфазной системе

Пар, находящийся в динамическом равновесии со своей жидкостью называется насыщенным паромНасыщенный парНенасыщенный пар
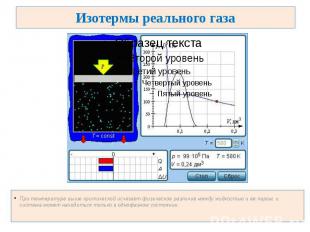
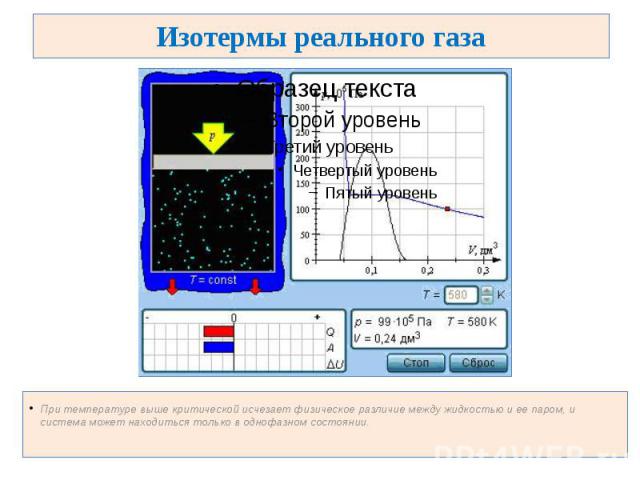
Изотермы реального газа При температуре выше критической исчезает физическое различие между жидкостью и ее паром, и система может находиться только в однофазном состоянии.
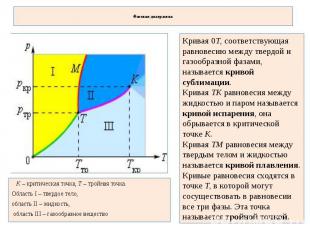
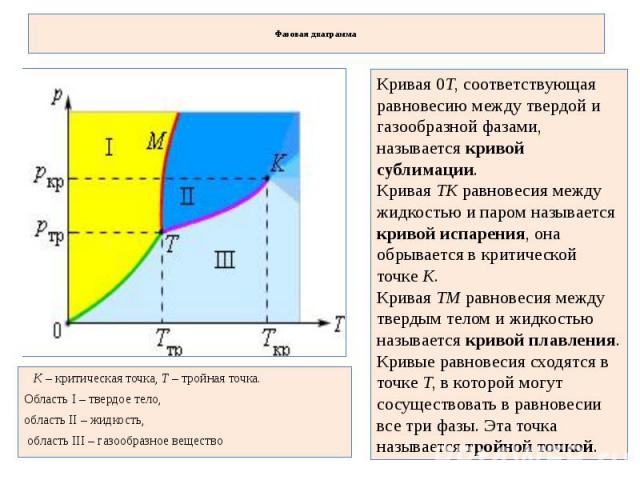
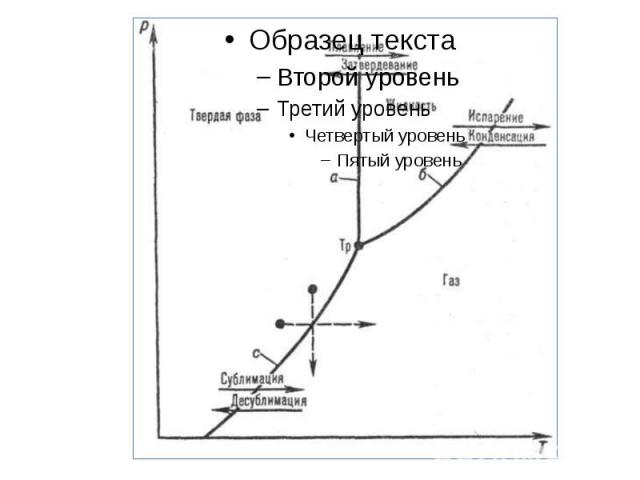
Фазовая диаграмма Кривая 0T, соответствующая равновесию между твердой и газообразной фазами, называется кривой сублимации. Кривая TK равновесия между жидкостью и паром называется кривой испарения, она обрывается в критической точке K. Кривая TM равновесия между твердым телом и жидкостью называется кривой плавления. Кривые равновесия сходятся в точке T, в которой могут сосуществовать в равновесии все три фазы. Эта точка называется тройной точкой. K – критическая точка, T – тройная точка. Область I – твердое тело, область II – жидкость, область III – газообразное вещество


Для многих веществ давление pтр в тройной точке меньше 1 атм ? 105 Па. Такие вещества при нагревании при атмосферном давлении плавятся. Например, тройная точка воды имеет координаты Tтр = 273,16 К, pтр = 6,02·102 Па и используется в качестве опорной для калибровки абсолютной температурной шкалы Кельвина. Существуют, однако, и такие вещества, у которых pтр превышает 1 атм. Так для углекислоты (CO2) давление pтр = 5,11 атм и температура Tтр = 216,5 К. Поэтому при атмосферном давлении твердая углекислота может существовать только при низкой температуре, а в жидком состоянии при p = 1 атм она вообще не существует. В твердом состоянии в равновесии со своим паром при атмосферном давлении углекислота находится при температуре 173 К или –80 °С. Это широко применяемый «сухой лед», который никогда не плавится, а только испаряется (сублимирует).

Тест по теме «Молекулярная физика» Следствиями теории «Термодинамика» являются:Описание фазовых переходовОписание цикла КарноОбъяснение молекулярного строения тел Создание материалов с заранее известными свойствамиФизическая модель, используемая в молекулярно-кинетической теории, это:Абсолютно твёрдое телоМатериальная точкаТермодинамическая системаИдеальный газ
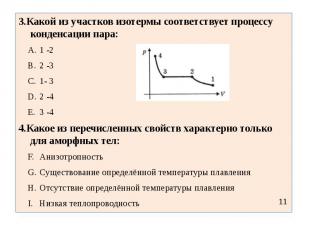
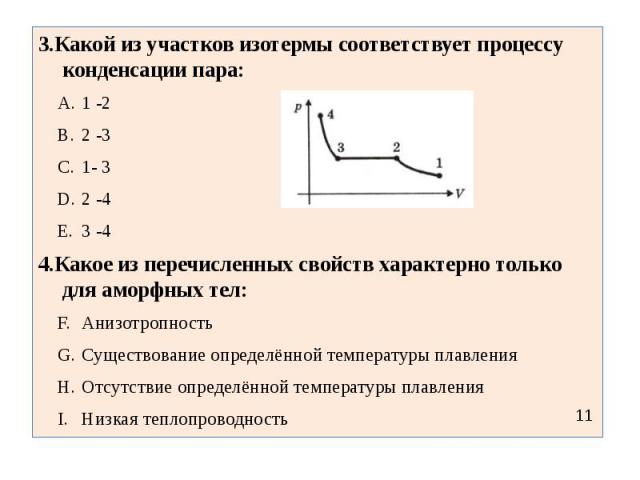
3.Какой из участков изотермы соответствует процессу конденсации пара:1 -22 -31- 32 -43 -44.Какое из перечисленных свойств характерно только для аморфных тел:АнизотропностьСуществование определённой температуры плавленияОтсутствие определённой температуры плавленияНизкая теплопроводность

5 .Объектом описания тепловых явлений статистическим методом является :Газ – макроскопическая системаГаз – микроскопическая системаИ то, и другоеНет правильного ответа6.Основными понятиями в молекулярно-кинетической теории являются :Масса молекулыВнутренняя энергияОбъём газаСредняя кинетическая энергия молекул

7.Формулировки II закона термодинамики предложили:Р.КлаузиусД.ДжоульУ. Томсон (Кельвин)Л. Больцман8. Следствием какого закона молекулярно-кинетической теории является закон, описывающий данный процесс:Уравнения состояния идеального газаОсновного уравнения молекулярно- кинетической теорииНи того, ни другогоИ того, и другого
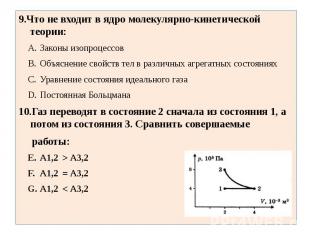
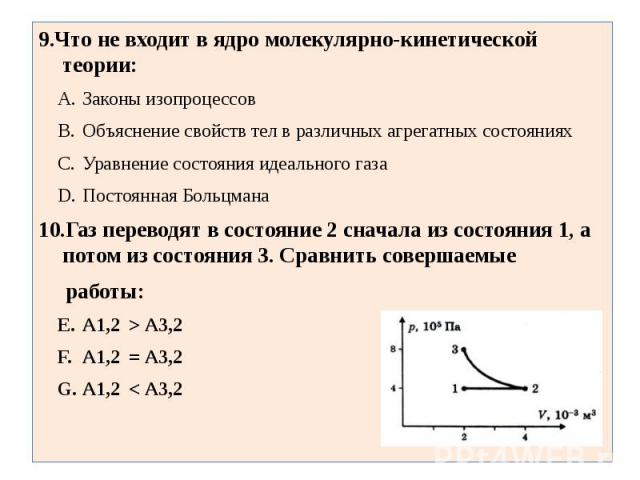
9.Что не входит в ядро молекулярно-кинетической теории:Законы изопроцессовОбъяснение свойств тел в различных агрегатных состоянияхУравнение состояния идеального газаПостоянная Больцмана10.Газ переводят в состояние 2 сначала из состояния 1, а потом из состояния 3. Сравнить совершаемые работы:А1,2 > А3,2 А1,2 = А3,2 А1,2 < А3,2

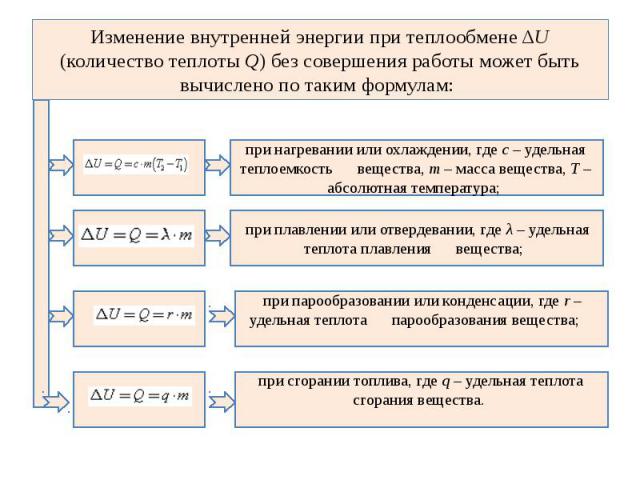
Изменение внутренней энергии при теплообмене ΔU (количество теплоты Q) без совершения работы может быть вычислено по таким формулам: при нагревании или охлаждении, где с – удельная теплоемкость вещества, m – масса вещества, Т – абсолютная температура; при плавлении или отвердевании, где λ – удельная теплота плавления вещества; при парообразовании или конденсации, где r – удельная теплота парообразования вещества; при сгорании топлива, где q – удельная теплота сгорания вещества.

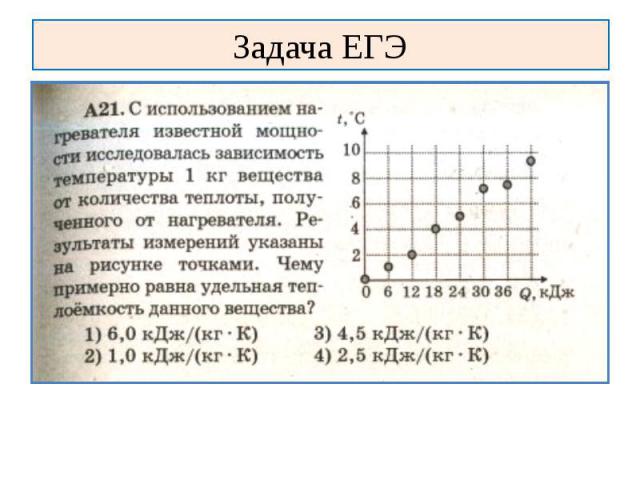
Задача ЕГЭ

Задача ЕГЭ

Задача ЕГЭ

Задача ЕГЭ
Использованные ресурсы: http://tvsh2004.narod.ru/phis.htmhttp://www.ido.rudn.ru/nfpk/fizika/mkt/3.html

Сабитова Файруза Рифовна преподаватель физикиГАОУ СПО «Сармановский аграрный колледж»