Презентация на тему: Водородная химическая связь

Теоретические основы органической химии Водородная и донорно-акцепторная связи Лекция 15 (электронно-лекционный курс) Проф. Бородкин Г.И. 900igr.net

Водородная связь Водородная связь играет важную роль во многих химических, физических и биохимических процессах Молекулы жизни Молекулы в кристаллах Перенос протона Ферментатив- ный катализ При определенных условиях атом водорода может быть связан сильной связью с двумя соседними атомами, а не с одним. Л. Полинг:

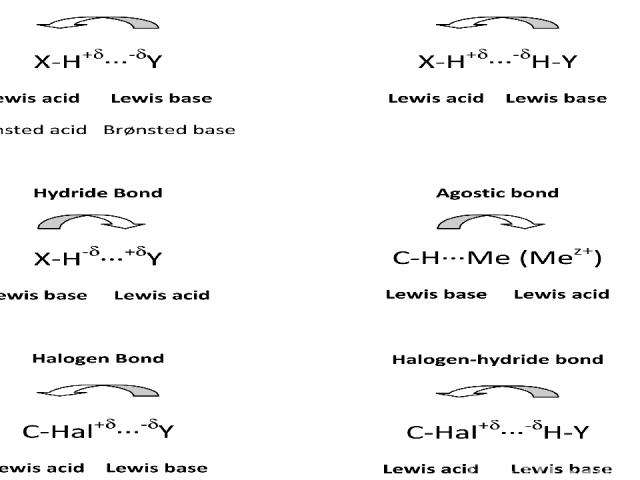
Первую научную трактовку водородной связи дали в 1920 году В. Латимер и В. Родебуш, работавшие в лаборатории Г. Льюиса, основоположника учения о ковалентной связи, автора теории кислот и оснований и плодотворной в органической химии концепции обобщенной электронной пары. Образование водородной связи наступает при взаимодействии протонодонора (кислоты Бренстеда, электроноакцептора) с протоноакцептором (основанием, электронодонором).
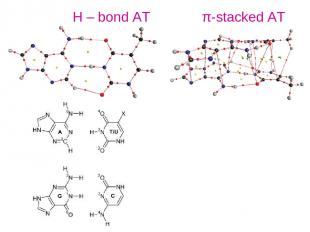
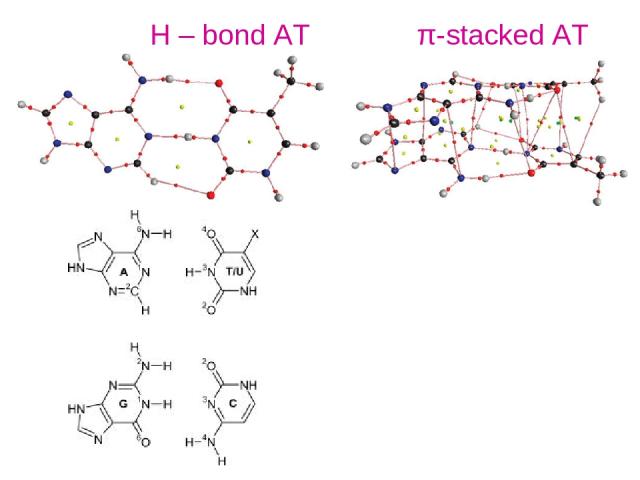
Н – bond AT π-stacked AT
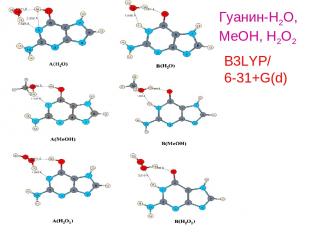
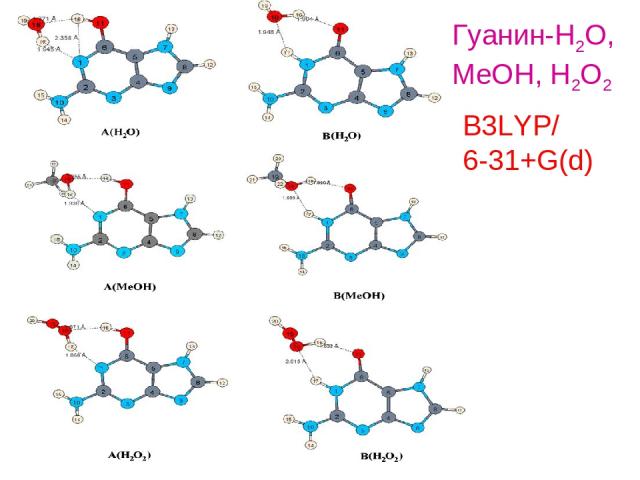
B3LYP/ 6-31+G(d) Гуанин-H2O, MeOH, H2O2
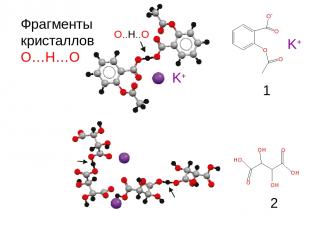
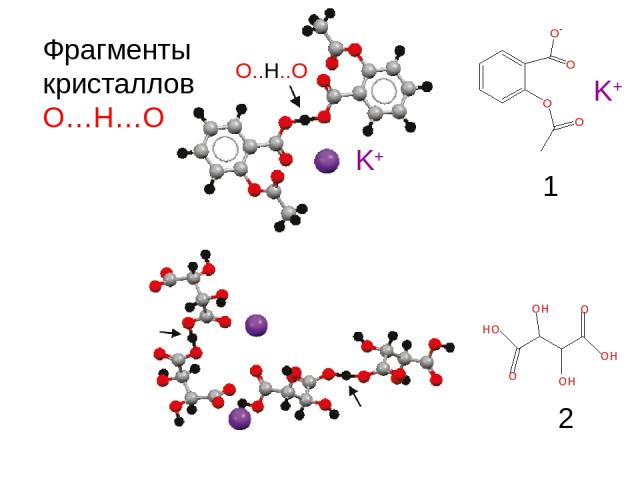
Фрагменты кристаллов О…Н…О K+ O..H..O 1 2 K+

Внутримолекулярную водородную связь отличают от межмолекулярной связи по признакам ассоциации. Межмолекулярная Н-связь «исчезает» при низкой концентрации вещества в нейтральном растворителе, тогда как внутримолекулярная Н-связь в этих условиях сохраняется. Типы водородных связей Внутримолекулярная Межмолекулярная
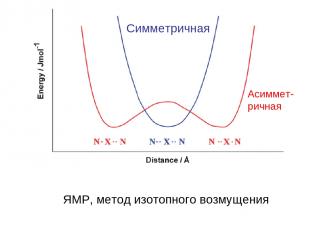
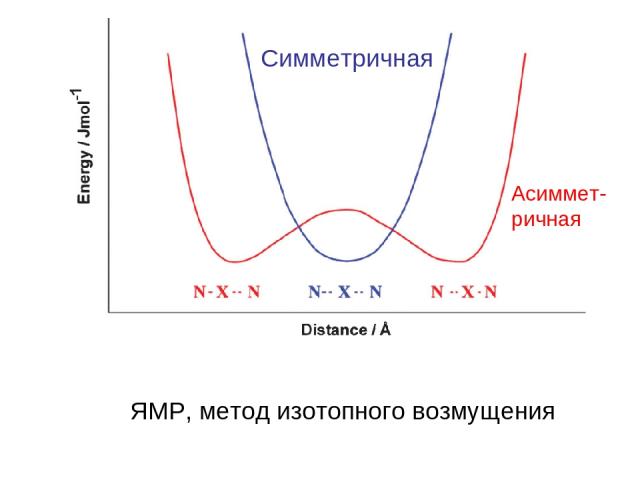
Cимметричная Асиммет- ричная ЯМР, метод изотопного возмущения
![CCSD(T)/6-311(3df,3pd)// CCSD/6-311(3df,3pd) Симметричные Н-связи [H….F….H]- H…. CCSD(T)/6-311(3df,3pd)// CCSD/6-311(3df,3pd) Симметричные Н-связи [H….F….H]- H….](https://fs3.ppt4web.ru/images/132073/183445/310/img10.jpg)
CCSD(T)/6-311(3df,3pd)// CCSD/6-311(3df,3pd) Симметричные Н-связи [H….F….H]- H….O….H Нейтронная дифракция (кристалл) Атом водорода посредине или близко к центру связи Grabowski, S. J.; Ugalde, J. M. Chem. Phys. Lett. 2010, 493, 37.

Природа водородной связи Morokuma and Kitaura (одноэлектронное приближение Hartree-Fock) E = EEX + ЕPOL + ЕCT + ЕES EEX - обменная энергия (отталкивание ē !) ЕPOL - поляризационная энергия ЕCT - энергия переноса заряда ЕES - энергия электростатичекого взаимодействия При малых расстояниях POL, ES и CT важны, при больших ES важно (Morokuma, K; Kitaura, K. In Molecular Interactions; Ratajczak, New York,1980; Vol. 1, p 21-66) Притяжение

Две молекулы описывают гамильтонианами НА и НВ а межмолекулярное взаимодействие слабое; V − оператор межмолекулярного взаимодействия Н0= НА + НВ Где: (1) (2) (3) i и j – электроны, A, B - ядра электрон-ядро электрон-электрон ядро-ядро

Энергия прямого электростатического взаимодействия невозмущенных молекул: Еo = (4) Энергия взаимной поляризации молекул: Еpol = - S II2 (ЕnA – EoA) + (EmB – EoB) (5) = Еind + Edisp Индукционная энергия Еind отвечает взаимодействию невозмущенной молекулы А с поляризованной ею молекулой В и наоборот. Энергия Еind отрицательна и для нейтральных молекул мала.

Дисперсионная энергия Еdisp отвечает взаимодействию двух взаимно поляризованных электронных распределений. Она определяется квантово-механическими флуктуациями электронной плотности и требует для расчета учета электронной корреляции. Еdisp = - S II2 (ЕnA – EoA) + (EmB – EoB) m, n = 0 (6)

Понятие «перенос заряда» следует понимать в том же смысле, что и понятие «валентная структура», в методе валентных связей: речь идет о включении в волновую функцию вклада состояний, отвечающих ионизированным молекулам комплекса. Перенос заряда зависит от разности энергией комплекса и энергией мономеров, описываемых антисимметризованным произведением волновых функций каждого из них.

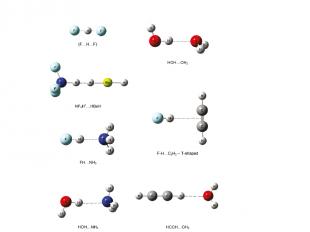
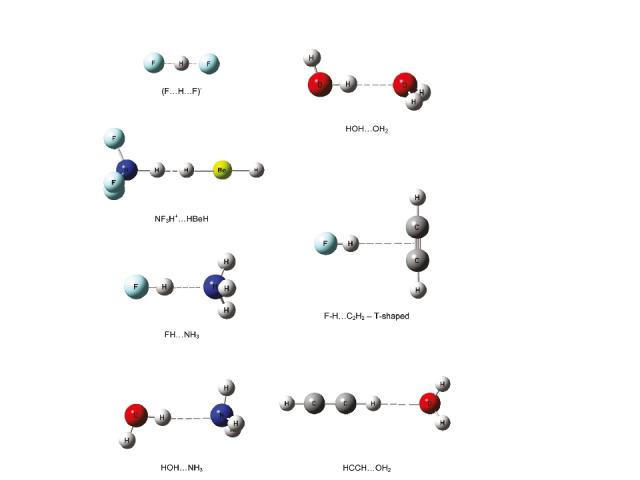
Комплекс DE (ккал/моль) RH…B(Å) MP2/6-311++G(d,p) HOH…OH2 -4.5 1.95 HOH…NH3 -5.9 1.97 FH…OH2 -7.7 1.73 [F…H…F]- -61.0 1.14 HCH…OH2 -2.5 2.44 F-H…H-Li -13.4 1.40 ΔE = E(R1-A-H… B-R2) – E(R1-A-H) – E(B-R2) Энергия межмолекулярной водородной связи Grabowski, S. J.; Sokalski, W. A. J. Phys. Org. Chem. 2005, 779
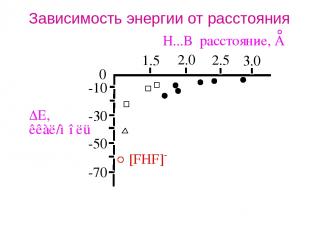
Зависимость энергии от расстояния

rn - rS = Δrns - c log n rn – rS - расстояние между атомами r и s n - порядок связи
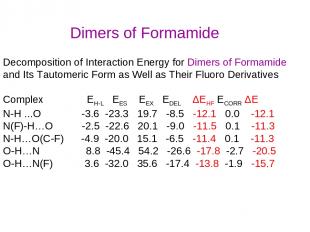
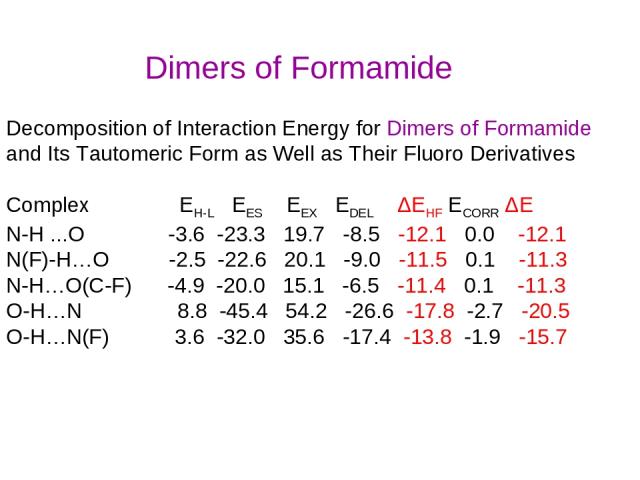
Decomposition of Interaction Energy for Dimers of Formamide and Its Tautomeric Form as Well as Their Fluoro Derivatives Complex EH-L EES EEX EDEL ΔEHF ECORR ΔE N-H ...O -3.6 -23.3 19.7 -8.5 -12.1 0.0 -12.1 N(F)-H…O -2.5 -22.6 20.1 -9.0 -11.5 0.1 -11.3 N-H…O(C-F) -4.9 -20.0 15.1 -6.5 -11.4 0.1 -11.3 O-H…N 8.8 -45.4 54.2 -26.6 -17.8 -2.7 -20.5 O-H…N(F) 3.6 -32.0 35.6 -17.4 -13.8 -1.9 -15.7 Dimers of Formamide
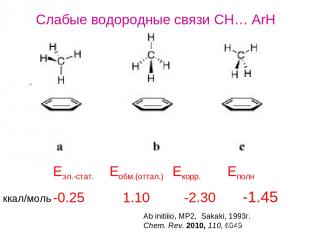
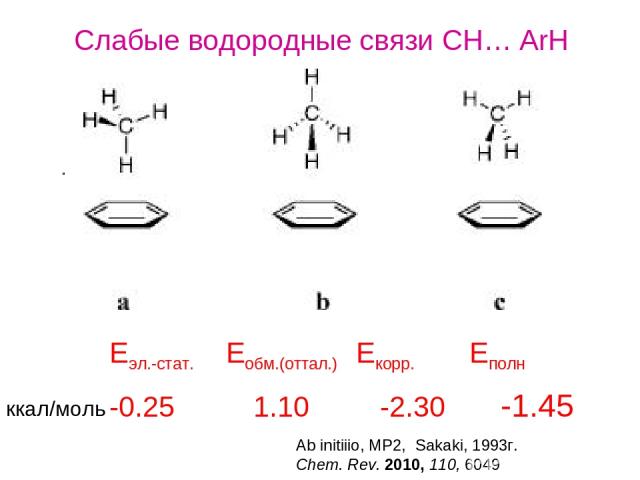
Слабые водородные связи CH… ArH -0.25 1.10 -2.30 -1.45 Eэл.-стат. Eобм.(оттал.) Екорр. Еполн Ab initiiio, MP2, Sakaki, 1993г. Chem. Rev. 2010, 110, 6049 ккал/моль

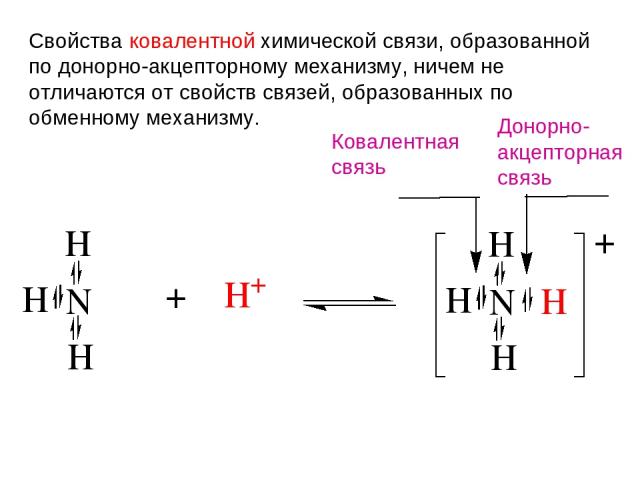
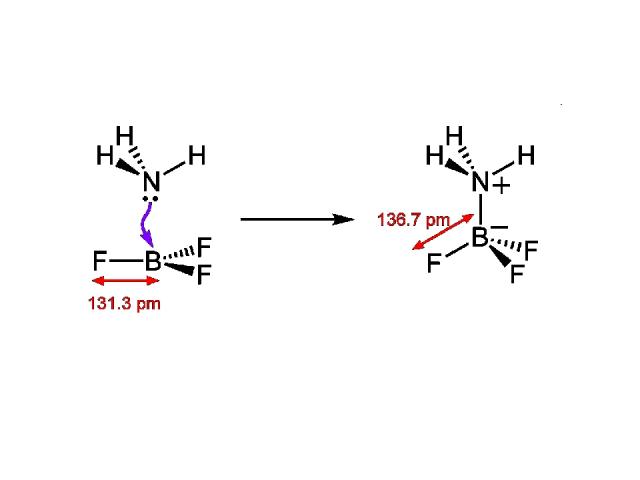
Донорно-акцепторная связь Донорно-акцепторная связь (координационная связь) — химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора). Термины «донорно-акцепторная связь» или «координационная связь» не всегда корректны, поскольку часто это не есть вид химической связи, а лишь теоретическая модель, описывающая особенность её образования.
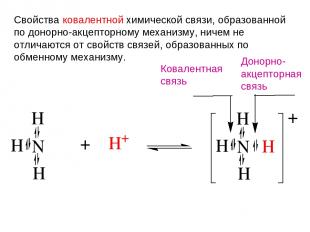
Свойства ковалентной химической связи, образованной по донорно-акцепторному механизму, ничем не отличаются от свойств связей, образованных по обменному механизму. Ковалентная связь Донорно- акцепторная связь
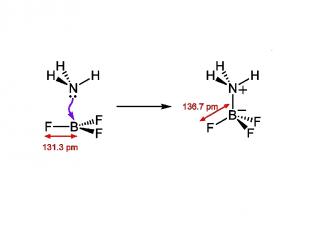

Согласно теории Малликена, основное (N) и возбужденное (Е) состояния молекулярных кoмплексов состава DА описываются волновыми ф-циями yN и yE: YN = aY0(D,A) + bY1(D+-A-) основное YE = a*Y0(D,A) - b*Y1(D+-A-) возбужденное Ф-ция y0 описывает гипотетич. состояние системы "без связи", когда расстояние между молекулами D и А равно длине донорно-акцепторной связи, а взаимод. между ними только электростатическое. Ф-ция y1 описывает состояние, в котором один из электронов с МО донора yD перенесен без изменения спина на МО акцептора yA, в результате чего образуется ковалентная связь. Суперпозиция гипотетич. состояний, отвечающих y1 и y0, соответствует реальному состоянию молекулярного кoмплекса.

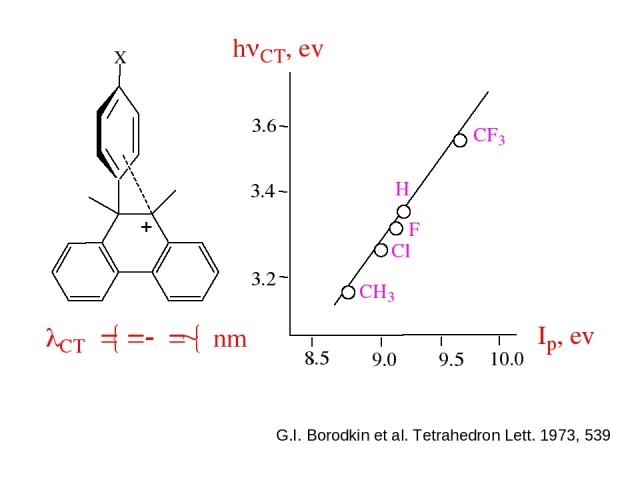
Для ряда молекулярных комплексов характерно появление в электронных спектрах новой полосы поглощения, отсутствовавшей в спектрах индивидуальных Д и А, называемой полосой переноса заряда. hn = ID — ЕА + С ID – потенциал ионизации донора ЕА- сродство к электрону акцептора С - константа
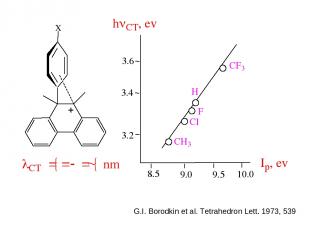
G.I. Borodkin et al. Tetrahedron Lett. 1973, 539

n-Доноры: RNH2, ROH, R2O, RSH, R2S и др. p-Доноры: ArH s-Доноры: H-CHal3 (пара электронов от s-связи) p-Акцепторы: кислоты Льюиса (p-вакантная АО), карбокатионы p-Акцепторы: хиноны и др. s-Акцепторы: s-разрыхляющая MO
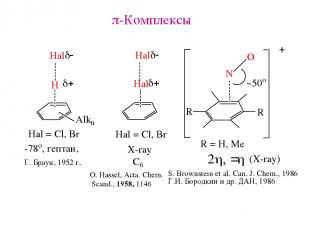
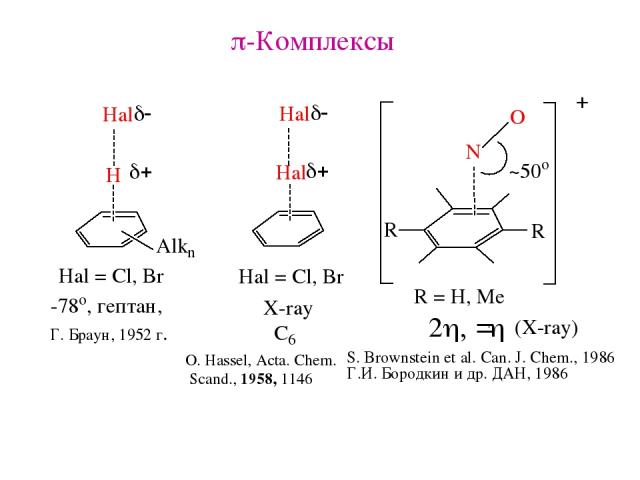
p-Комплексы O. Hassel, Acta. Chem. Scand., 1958, 1146
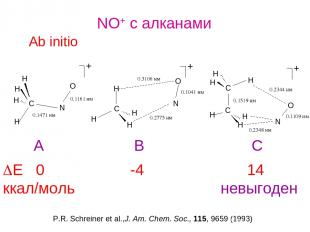
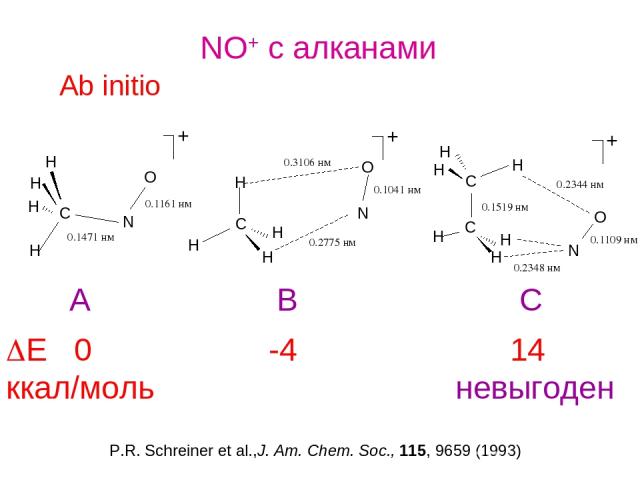
NO+ c алканами Ab initio DE 0 -4 14 ккал/моль невыгоден P.R. Schreiner et al.,J. Am. Chem. Soc., 115, 9659 (1993) A B C
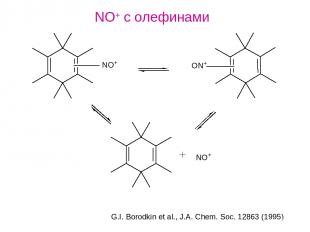
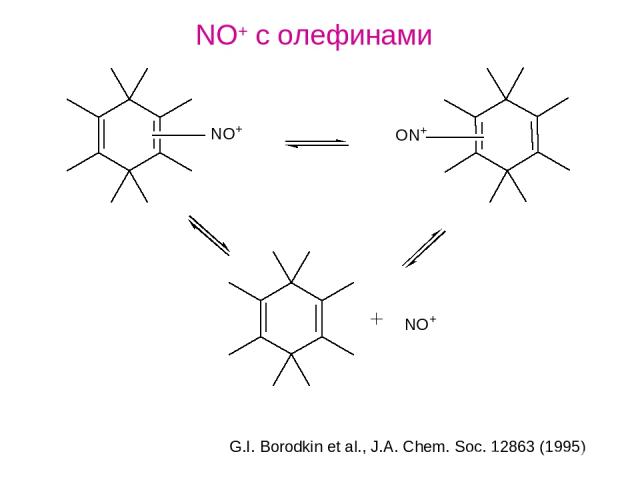
NO+ с олефинами G.I. Borodkin et al., J.A. Chem. Soc. 12863 (1995)
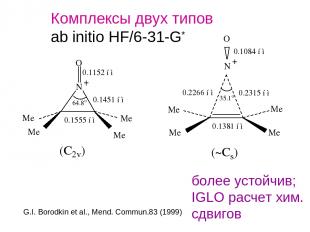
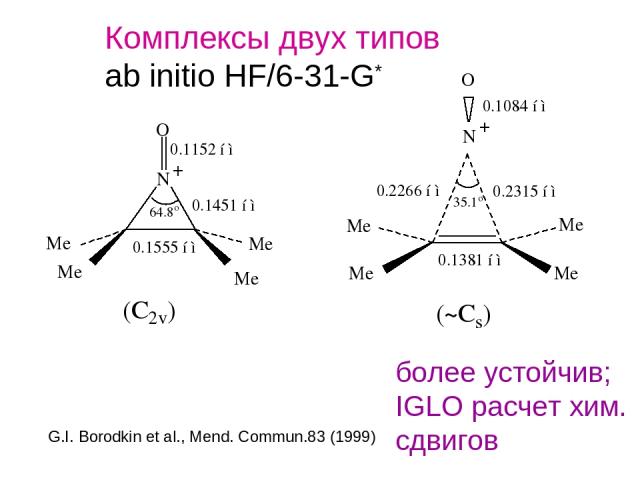
Комплексы двух типов ab initio HF/6-31-G* более устойчив; IGLO расчет хим. сдвигов G.I. Borodkin et al., Mend. Commun.83 (1999)
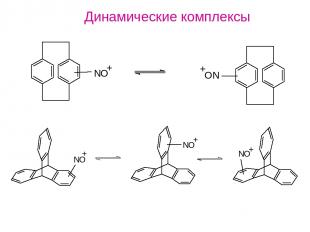
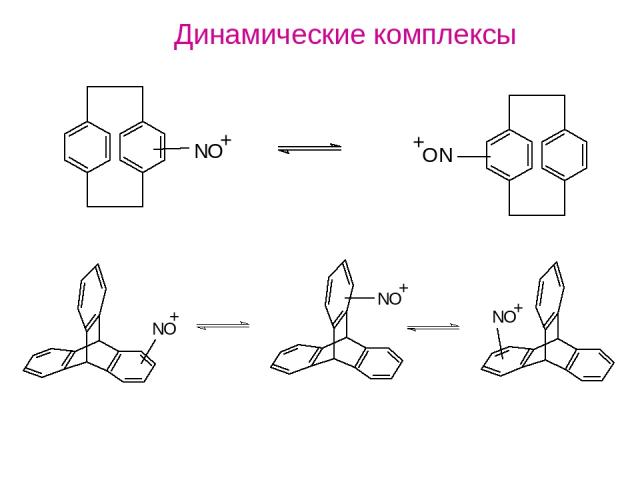
Динамические комплексы
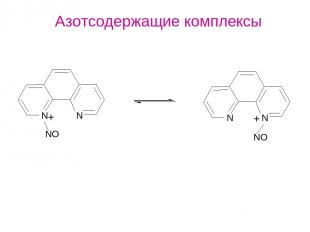
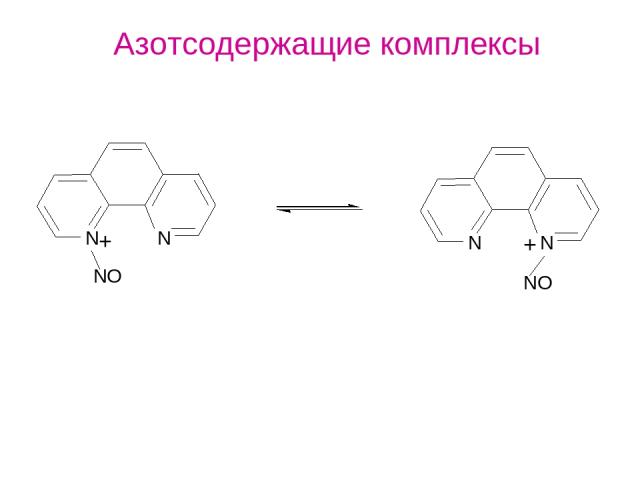
Азотсодержащие комплексы
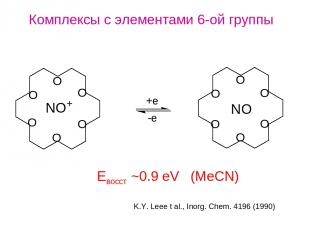
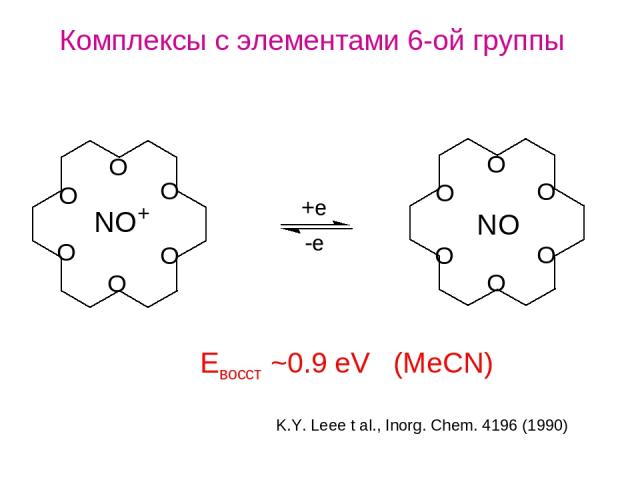
Комплексы с элементами 6-ой группы K.Y. Leee t al., Inorg. Chem. 4196 (1990) Eвосст ~0.9 eV (MeCN)
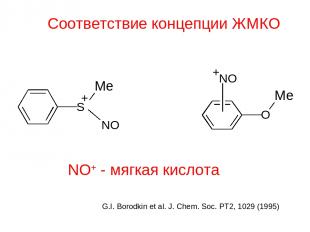
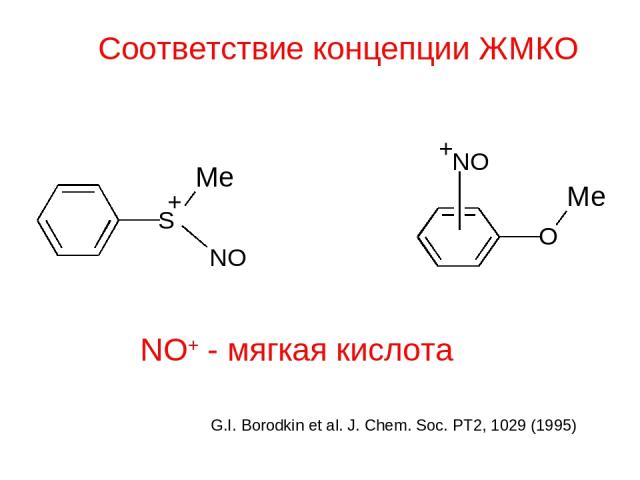
Соответствие концепции ЖМКО NO+ - мягкая кислота G.I. Borodkin et al. J. Chem. Soc. PT2, 1029 (1995)
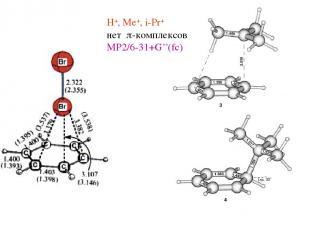
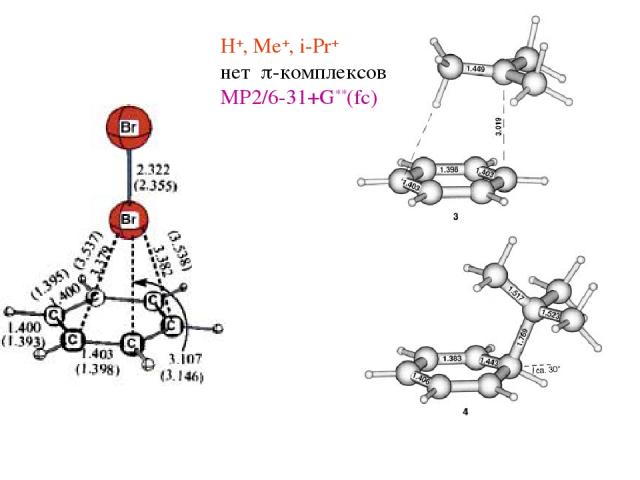
H+, Me+, i-Pr+ нет p-комплексов MP2/6-31+G**(fc)

Eэл-стат - энергия электростатического взаимодействия Еполяр - поляризационная энергия, Еобм - энергия обменного взаимод., Епз - энергия, связанная с переносом заряда, Ев.п - энергия высших порядков, определяемая как разность между ЕДА и первых четырех членов разложения (ab initio) EДА = Eэл-стат + Еполяр. + Еобм + Епз + Ев.п К. Морокума классифицировал молекулярные кoмплексы по энергии связи: cильные (сотни кДж/моль), средние (десятки кДж/моль), cлабые (единицы кДж/моль) По природе связи: электростатические, поляризационные, с переносом заряда
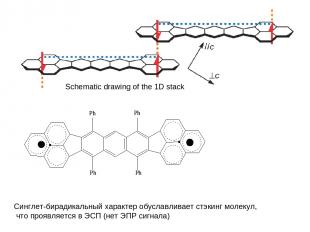
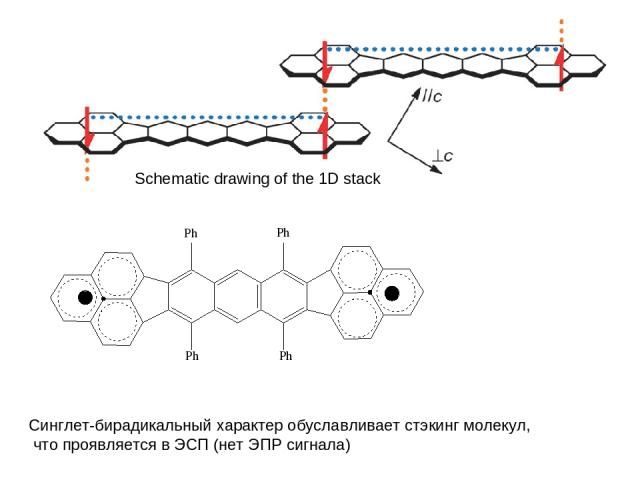
Schematic drawing of the 1D stack Синглет-бирадикальный характер обуславливает стэкинг молекул, что проявляется в ЭСП (нет ЭПР сигнала)





![CCSD(T)/6-311(3df,3pd)// CCSD/6-311(3df,3pd) Симметричные Н-связи [H….F….H]- H….O….H Нейтронная дифракция (кристалл) Атом водорода посредине или близко к центру связи Grabowski, S. J.; Ugalde, J. M. Chem. Phys. Lett. 2010, 493, 37. CCSD(T)/6-311(3df,3pd)// CCSD/6-311(3df,3pd) Симметричные Н-связи [H….F….H]- H….O….H Нейтронная дифракция (кристалл) Атом водорода посредине или близко к центру связи Grabowski, S. J.; Ugalde, J. M. Chem. Phys. Lett. 2010, 493, 37.](https://fs3.ppt4web.ru/images/132073/183445/640/img10.jpg)





![Комплекс DE (ккал/моль) RH…B(Å) MP2/6-311++G(d,p) HOH…OH2 -4.5 1.95 HOH…NH3 -5.9 1.97 FH…OH2 -7.7 1.73 [F…H…F]- -61.0 1.14 HCH…OH2 -2.5 2.44 F-H…H-Li -13.4 1.40 ΔE = E(R1-A-H… B-R2) – E(R1-A-H) – E(B-R2) Энергия межмолекулярной водородной связи Grab… Комплекс DE (ккал/моль) RH…B(Å) MP2/6-311++G(d,p) HOH…OH2 -4.5 1.95 HOH…NH3 -5.9 1.97 FH…OH2 -7.7 1.73 [F…H…F]- -61.0 1.14 HCH…OH2 -2.5 2.44 F-H…H-Li -13.4 1.40 ΔE = E(R1-A-H… B-R2) – E(R1-A-H) – E(B-R2) Энергия межмолекулярной водородной связи Grab…](https://fs3.ppt4web.ru/images/132073/183445/640/img16.jpg)