Презентация на тему: Метали

Метали
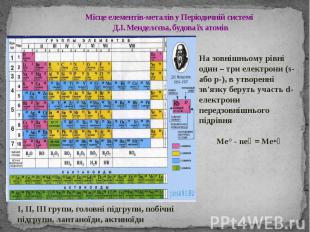
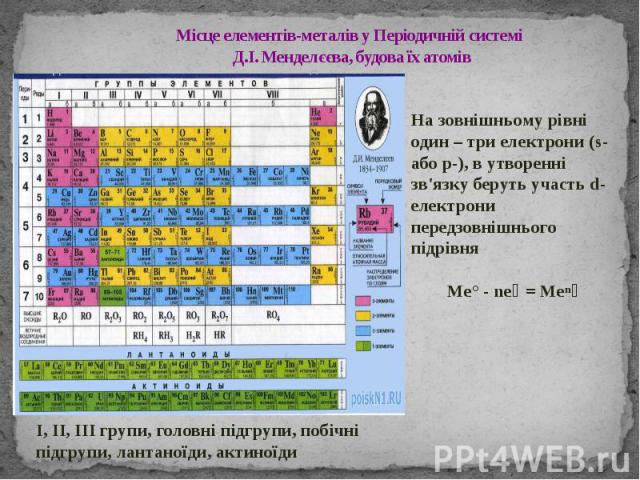
Місце елементів-металів у Періодичній системі Д.І. Менделєєва, будова їх атомів

Металевий зв’язок і кристалічна гратка Металічна кристалічна гратка

Загальні фізичні властивості металів Агрегатний стан: тверді, за винятком Hg, Ga. Колір: усі відтінки від сірого до чорного (винятки Cu, Au). Тепло – й електропровідність (за рахунок вільних електронів) збільшуються в ряді Hg, Pb, Fe, Zn, Mg, Al, Au, Cu, Ag. Ковкість і пластичність (йони безпосередньо один з одним не зв'язані, тому окремі їх шари можуть зміщатися один відносно одного). Найбільш пластичний метал – золото, найбільш крихкий – хром, манган, стибій. Густина: легкі – ρ < 5 г/см ³ (ρ (Li) = 0,53 г/см ³); важкі – ρ > 5 г/см ³ (ρ (Os) = 22,48 г/см ³). Твердість: м'які (лужні метали); тверді (хром). Температура плавлення: легкоплавкі – Tпл (Hg) = 38,87 С; тугоплавкі – Тпл (W)=3370 С. Температура кипіння в металів висока.



Якісні реакції Na⁺ - дає жовте полум'я; К⁺ - дає фіолетове полум'я; Са²⁺ - дає яскраво-червоне полум'я; Al³⁺ - з лугами дає білий осад, що розчиняється в надлишку лугу; Fe²⁺ - з лугами дає зеленуватий осад, який на повітрі буріє; Fe³⁺ - у лужному середовищі дає бурий осад.

Хімічні властивості металів Ме

Взаємодія лужного металу з водою

Взаємодія лужноземельного металу з водою

Горіння магнію

Реакція горіння кальцію в повітрі (реакція протікає бурхливо)

Реакція горіння літію

Каталітична реакція взаємодії алюмінію з йодом

Оксиди металів

Гідроксиди Основи: LiOH KOH NaOH + кислота сіль + вода Ca(OH)₂ Fe(OH)₂ Амфотерні: Al(OH)₃, Fe(OH)₃ Ме(ОН)₃ + кислота сіль + вода Ме(ОН)₃ + луг сіль

Загальні способи одержання металів 1. Найактивніші (K, Ca, Mg, Na) відновлюють електролізом. Електроліз – окисно-відновна реакція під дією постійного електричного струму. 2NaCl = 2Na + Cl₂ На катоді: Na⁺ + e⁻ = Na° - відновлення катіонів. На аноді: Cl⁻ - e⁻ = Cl° - окиснення аніонів.

2. Менш активні метали відновлюють з оксидів або сульфідів (після попереднього випалу): а) коксом за високих температур: SnO₂ + C = CO₂ + Sn б) карбон (ІІ) оксидом: Fe₂O₃ + 3CO = 3CO₂ + 2Fe в) воднем: Fe₂O₃ + 3H₂ = 2Fe + 3H₂O г) іншими більш активними металами, наприклад алюмінієм (алюмінотермія): 3MnO₂ + 4Al = 2Al₂O₃ + 3MnO д) силіцієм (силікотермія): 2Al₂O₃ + 3Si = 4Al + 3SiO₂