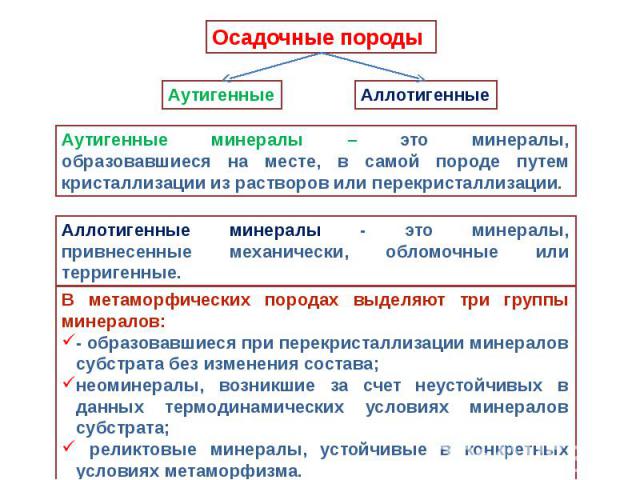
Презентация на тему: петрология
Минералогия Петрология
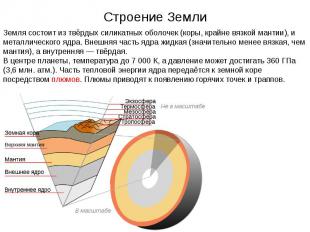
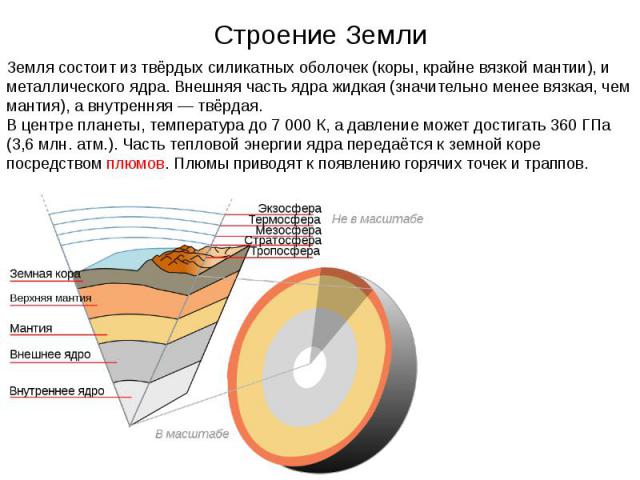
Строение Земли
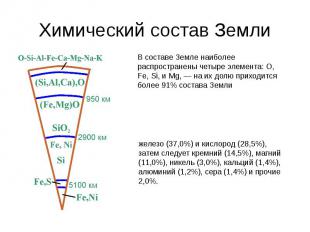
Химический состав Земли

Химический состав Земли

Минералогия как наука Минералогия — наука о минералах, их составе, строении, свойствах, условиях образования и изменения. Зародилась эта наука в глубокой древности в процессе практической деятельности, человека. О тесной связи минералогии и практики говорит само название науки: латинское слово «minera» в переводе означает руда, рудник, рудная жила.

Под минералом понимается продукт природных физико-химических процессов в земной коре или в космосе, обособленный от окружающей среды и обладающий определённым химическим составом и кристаллической решёткой. Предметом минералогии являются не только продукты природных процессов — минералы, а и сами процессы, при которых возникают или претерпевают различные изменения эти продукты.

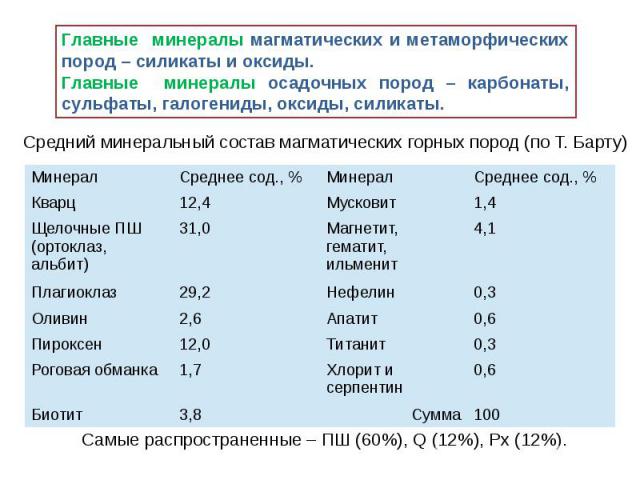
Химический состав и свойства минералов В состав минералов входят почти все химические элементы таблицы Менделеева, однако их участие в составе минералов неодинаковое. Наряду с главными элементами, определяющими самостоятельность минерального вида, имеются элементы, входящие в минерал лишь в качестве примесей. Так, например, кремний (Si) образует более 400 минералов, примесями могут быть Са, Mg, Fe, Mn, Al, Сr. В настоящий момент не известны минералы образованные рубидием(Rb)и гафнием (Gf).

Минералы – химические соединения I.Гомоатомные соединения В случае образования минерала из одного химического элемент они называются гомоатомные. К ним относятся минералы типа простых веществ и самородных элементов. Например золото, серебро, платины, алмаз, и т.п. эти минералы имеют специфические свойства: - инертность в отношении химического взаимодействия с другими элементами. Они как правило химически устойчивые в условиях земной поверхности; - практически всегда имеют примеси, хоть в небольших количествах (доли %); - в структурном отношении они в большинстве своем кристаллизуются в кубической сингонии.

II. Простые соли (бинарные соединения) Простые соли в большинстве представляют собой бинарные соединениями, т.е. соединения в состав которых входят только два элемента (катион и анион). Катионы в них могут образовывать соединения с различными анионами. Например: с серой – сульфиды ( FeS2 ) с хлором – хлориды (NaCl) , с фтором – фториды (CaF2) Среди них встречаются такие, у которых несколько катионов соединены с определенным анионом (халькопирит - CuFeS2, перовскит - CaTiO2). Эти соединения также рассматриваются как бинарные: у которых сумма положительно заряженных частиц (+) находится в строгом соответствии к сумме отрицательно заряженных частиц (-).

III. Комплексные соединения Комплексные соединения – наиболее распространены в природе минералов. Они характеризуются определенными радикалами, т.е. группами атомов с отрицательной валентностью, которые участвуют в химических реакциях как одно целое; Главными радикалами являются: силикаты-SiO4, фосфаты-PO4, карбонаты-CO3, сульфаты-SO4, нитраты-NO4; Радикалы являются комплексными анионами и присоединяют при образовании минералов количество катионов, необходимое для компенсации отрицательной валентности. В комплексных анионах малые высоковалентные катионы, окружены большими низковалентными анионами. Например: в силикатах - очень мелкие ионы кремния (Si) окружены крупными атомами кислорода (О); Комплексные анионы представляют собой в кристаллической решетке самостоятельные анионные группы с небольшим координационным числом центрального катиона. Прочность валентной связи между центральным катионом комплекса и окружающими его анионами больше, чем между этими анионами и катионами расположенные вне комплекса. Например: для кальцита внутри группы заряд углерода равен +2, а КЧ=3, т.е. прочность связи между С и О выражается отношением 4/3, в то время как вне комплекса заряд кальция =2, а координационное число = 6, т.е. прочность связи между Са и О = 2/6 (1/3). Внутри комплекса прочность связи всегда >1. Комплексные анионы по сравнению с простыми ионами выделяются большой величиной своих радиусов. Например: радиус сульфат-иона (SO4)=2,95А, а радиус О=1,32 А; В минералогии в качестве комплексных ионов встречаются почти исключительно радикалы простых кислородных кислот.

IV. Двойные соли Двойные соли - пользуются широким развитием в минеральном мире. Они представляют собой соединения, содержащие два или более типов катионов, занимающих в кристаллической решетке особые места. Обычно кислородный радикал у обеих солей бывает одинаков, например: доломит – CaMg[CO3]2, но также бывают двойные соли с различными кислотными радикалами: каинит – KCl*Mg[SO4]*3H2O. . Наиболее склонными к образованию двойных солей оказываются катионы, обладающие наибольшей основностью, уменьшающейся с увеличением заряда катиона и уменьшением размера ионного радиуса. Наиболее активные катионы обладают наибольшим ВЭКом, к ним относятся щелочные металлы К+, Na+ и т.д. Понятие ВЭКа был введён А.Е.Ферсманом в середине 50-х годов прошлого века. ВЭК – средний пай энергии, вносимый данным ионом в кристаллическую решётку, отнесённый к единице валентности.

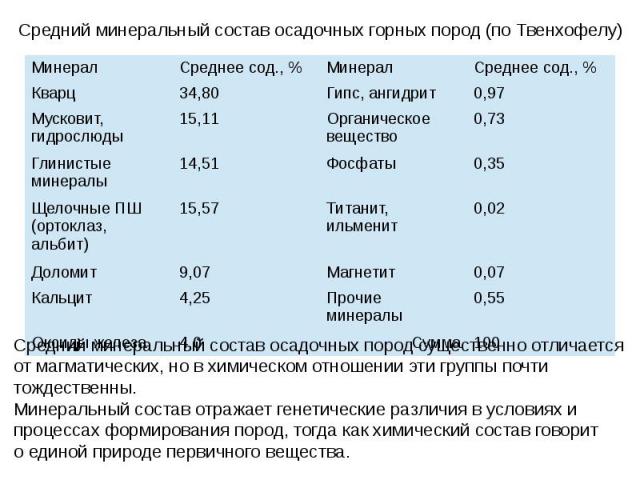
Формулы минералов. Состав минерала обозначается химической формулой, которая условно отражает качественную и количественную характеристику слагающих минерал элементов. Формулы минералов могут быть эмпирическими и структурными. Эмпирические формулы выражают количественный состав минералов и не дают представления о сочетаниях и связях составляющих минерал элементов; Структурные формулы не только дают представление о химическом составе, но и позволяют судить о типе химического соединения и о взаимных связях между отдельными элементами. Формулы минералов составляются по данным валового химического анализа и выражаются в %. При сокращённом написании структурных формул близко связанные друг с другом атомы выделяют в группы посредством круглых скобок, а радикалы – квадратные скобки. Например: форстерит – Mg2[SiO4], каолинит – Al4(OH)8[Si4O10] . Молекулы воды в кристаллогидратах пишутся в конце формулы Например:гипс -Ca[SO4]*2H2O. Если в формуле есть дополнительные анионы ОН, и др. они ставятся перед радикалом Например: апатит - Ca5(F,Cl,OH)[PO4]3. Изоморфные группы заключаются вместе в круглые скобки и отделяются друг от друга запятыми, причем элементы присутствуют в большом количестве пишутся впереди. Например: сфалерит - (Zn, Fe, Mg, Cu, Ge, Yn, Tl,) S.
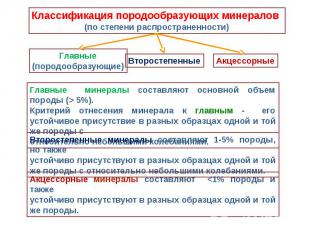



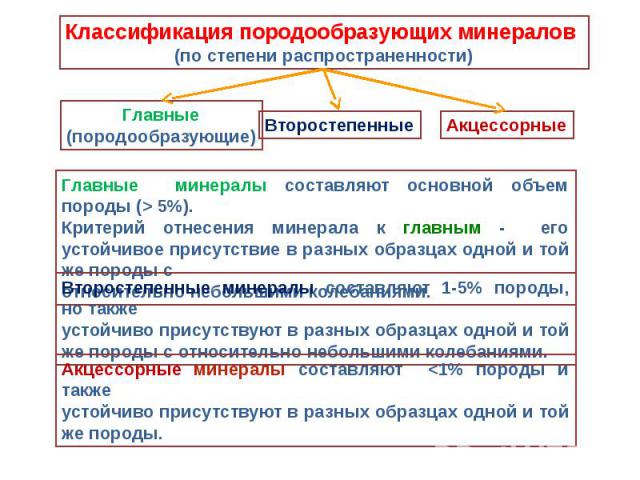
Формы нахождения минералов в природе Формы нахождения минералов в природе определяются особенностями их внутреннего строения,составом,усло- виями образования. Большинство минералов- кристаллические вещества. Одиночные кристаллы в природе встречаются сравнительно редко, чаще приходиться иметь дело с минеральными агрегатами.

Друзы минералов

Сростки мелких кристаллов называются - щетки Сростки мелких кристаллов называются - щетки

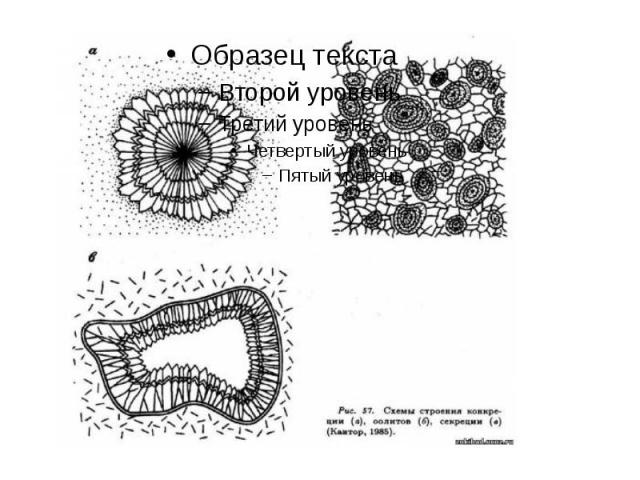
Кристаллизация минералов часто происходит в трещинах и пустотах горных пород. К формам заполнения пустот относятся конкреции,секреции,сталактиты,сталагми-ты,дендриты

конкреции

Сталактиты и сталагмиты

дендриды
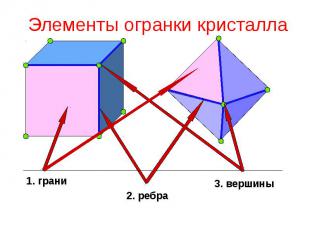
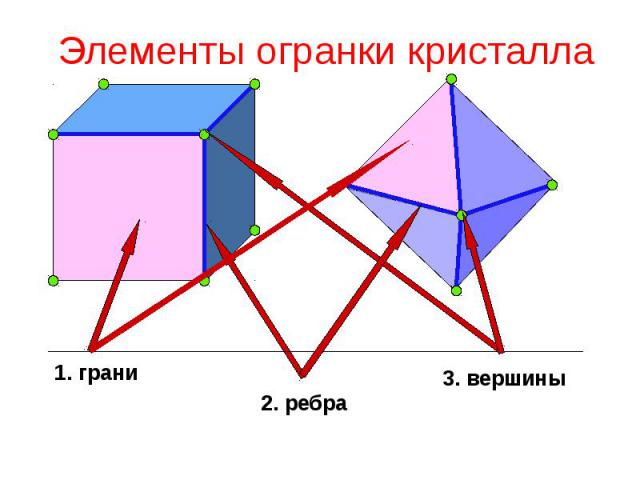
Элементы огранки кристалла
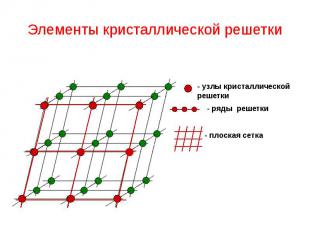
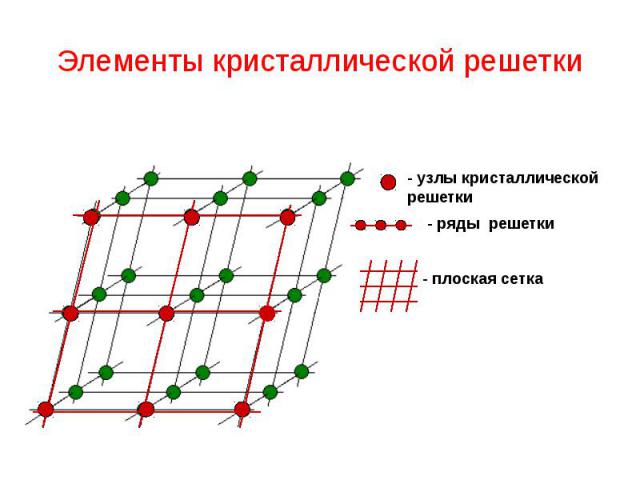
Элементы кристаллической решетки
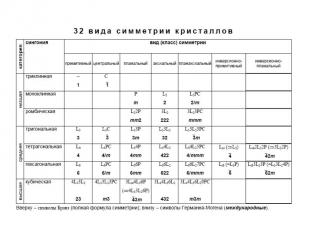
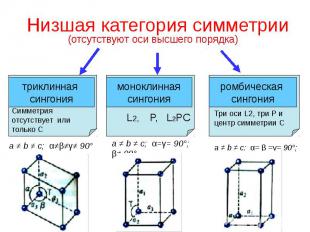
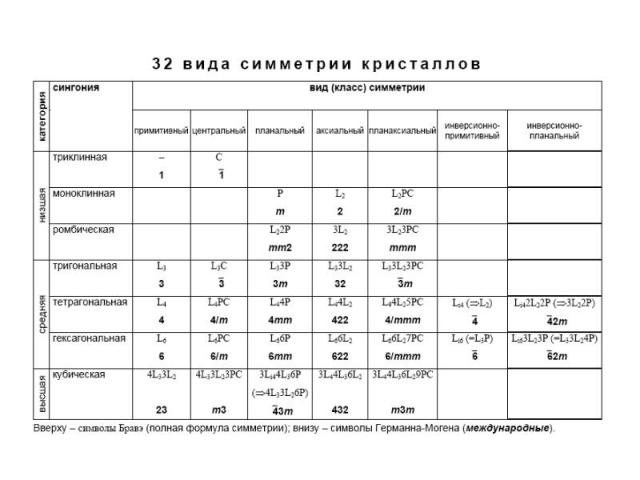
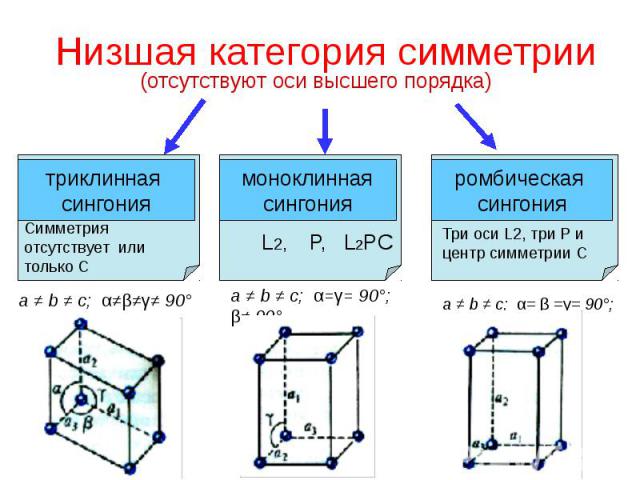
Низшая категория симметрии
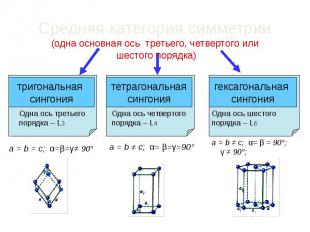
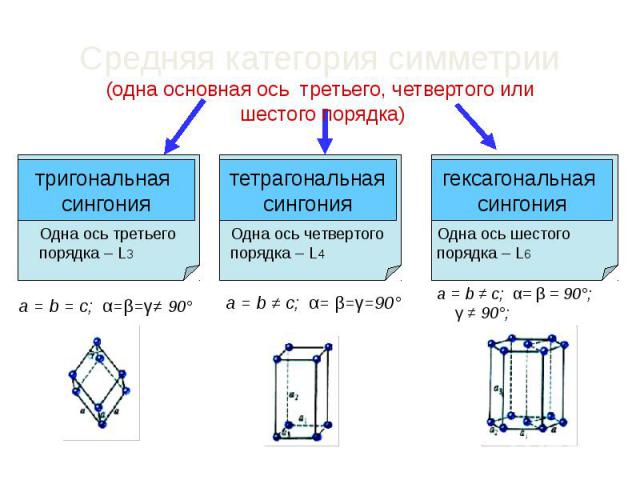
Средняя категория симметрии (одна основная ось третьего, четвертого или шестого порядка)
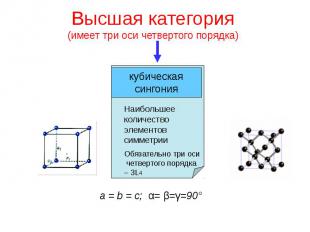
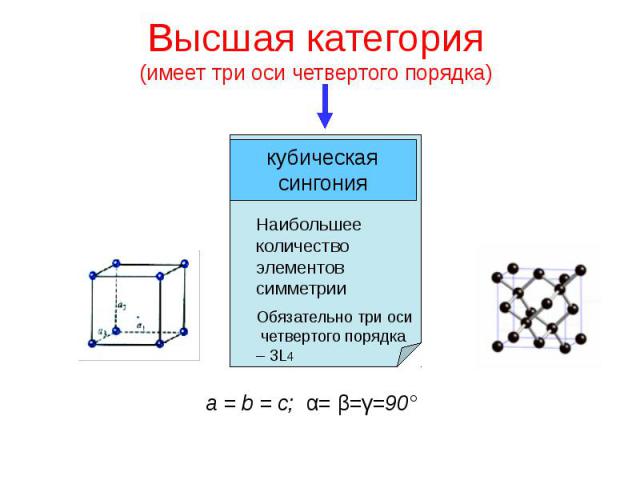
Высшая категория (имеет три оси четвертого порядка)
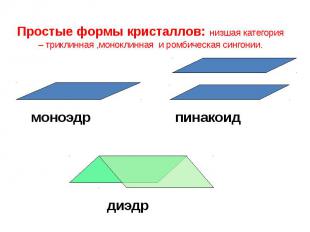
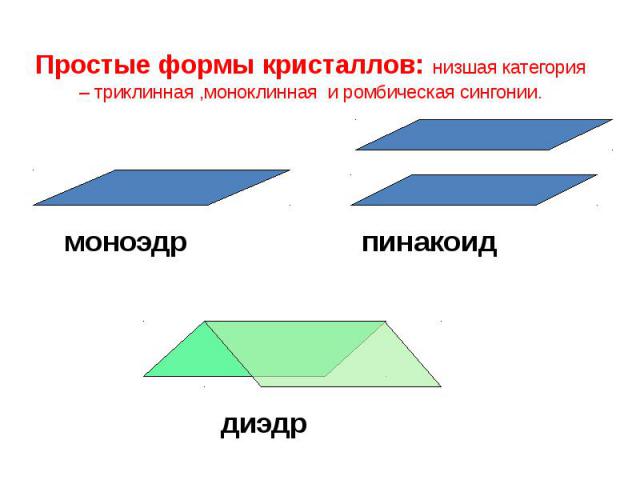
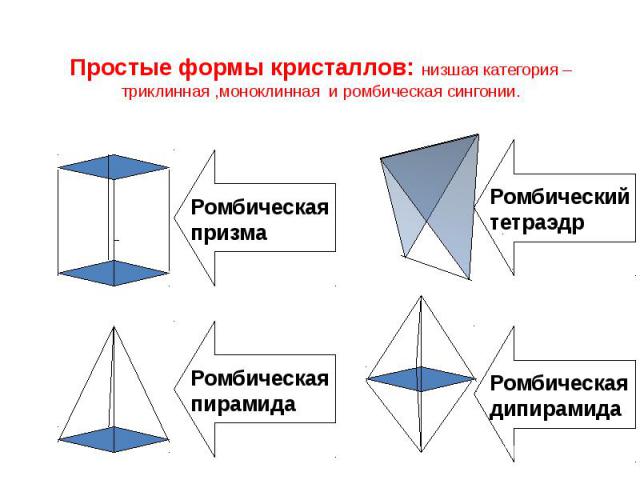
Простые формы кристаллов: низшая категория – триклинная ,моноклинная и ромбическая сингонии.
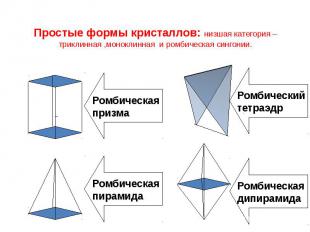
Простые формы кристаллов: низшая категория – триклинная ,моноклинная и ромбическая сингонии.
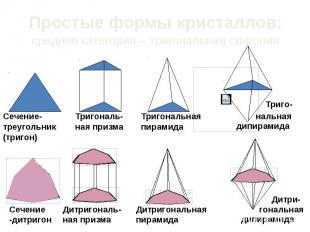
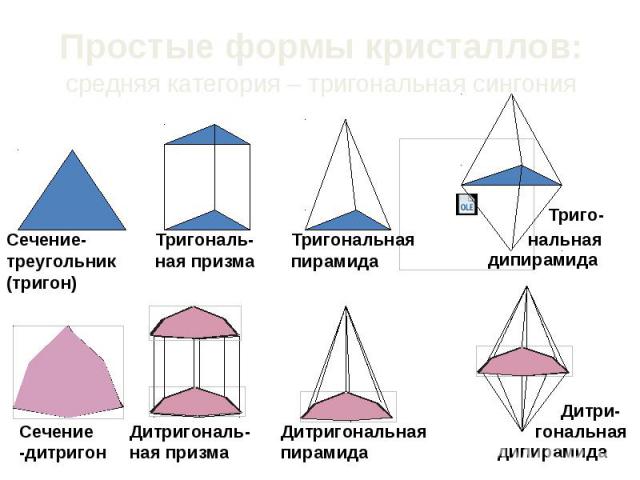
Простые формы кристаллов: средняя категория – тригональная сингония
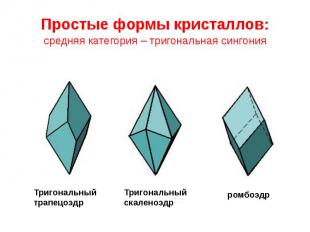
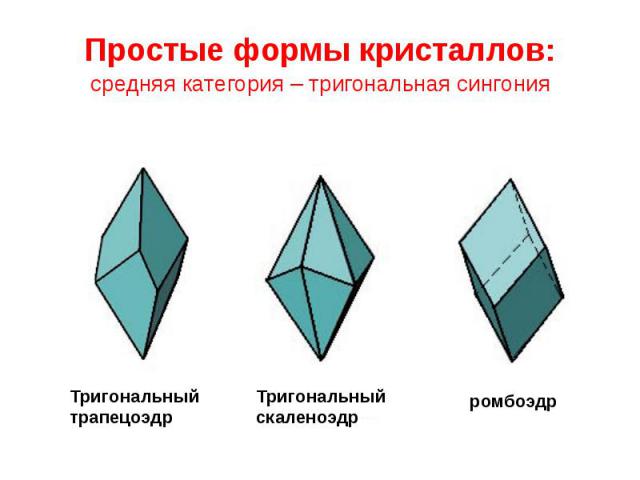
Простые формы кристаллов: средняя категория – тригональная сингония
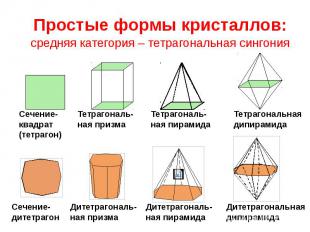
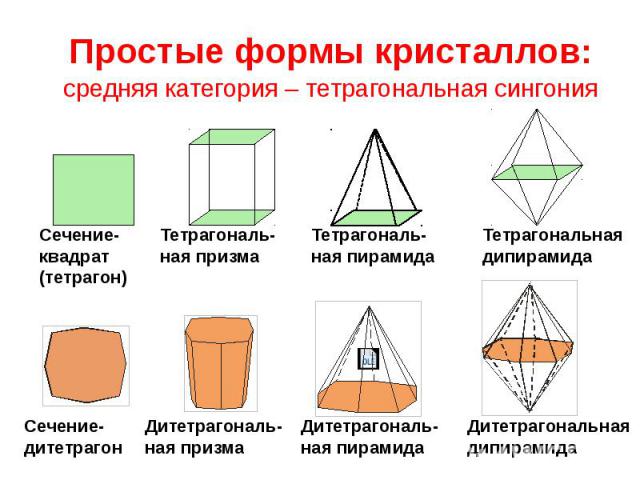
Простые формы кристаллов: средняя категория – тетрагональная сингония
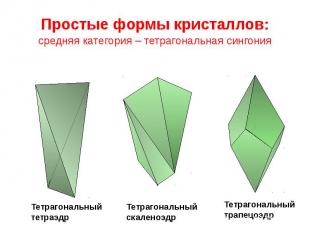
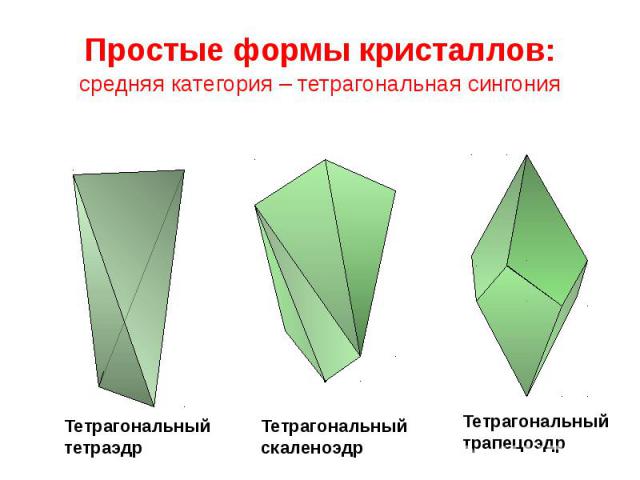
Простые формы кристаллов: средняя категория – тетрагональная сингония
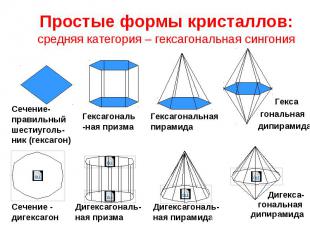
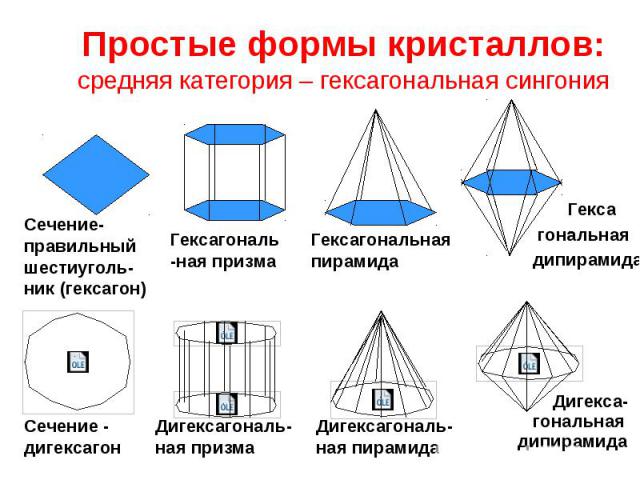
Простые формы кристаллов: средняя категория – гексагональная сингония

Простые формы кристаллов: средняя категория – гексагональная сингония
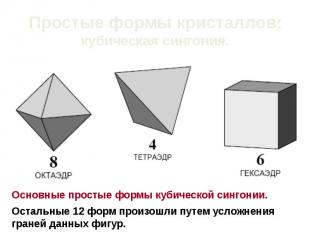
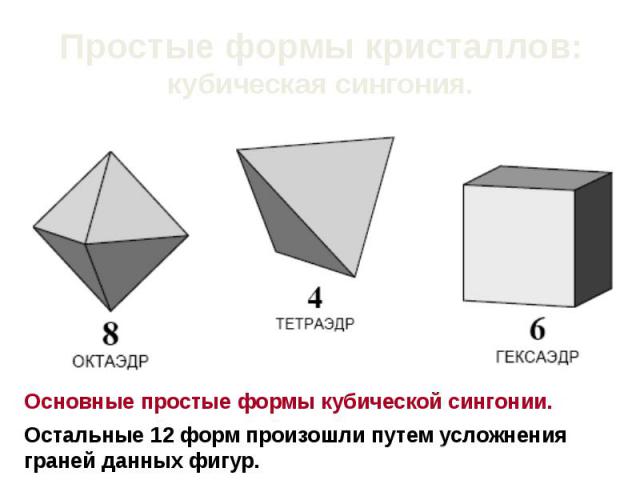
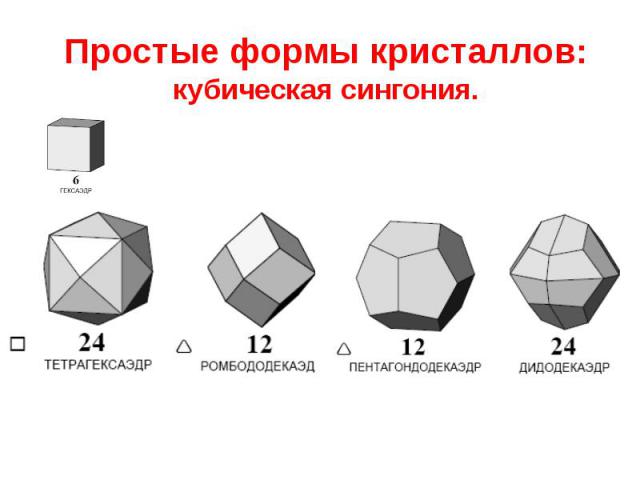
Простые формы кристаллов: кубическая сингония.
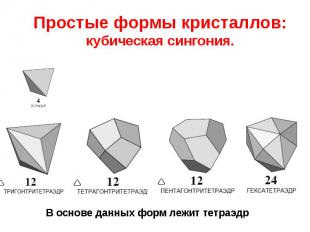
Простые формы кристаллов: кубическая сингония.
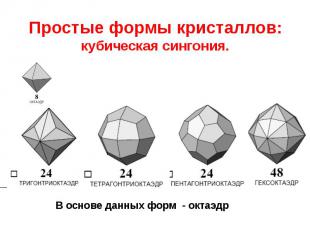
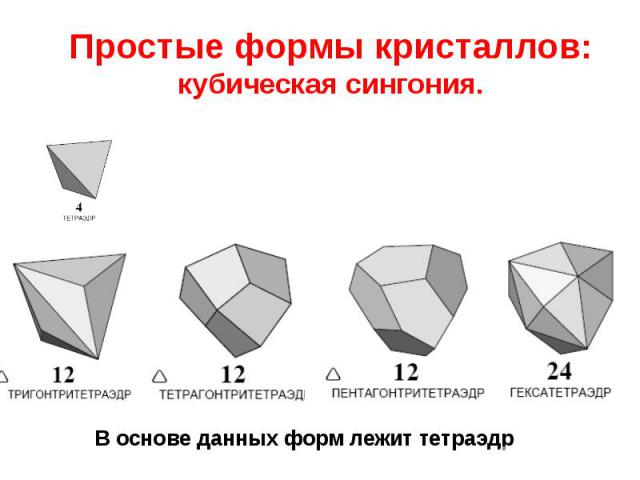
Простые формы кристаллов: кубическая сингония.
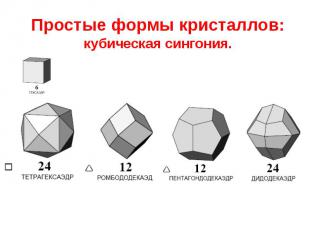
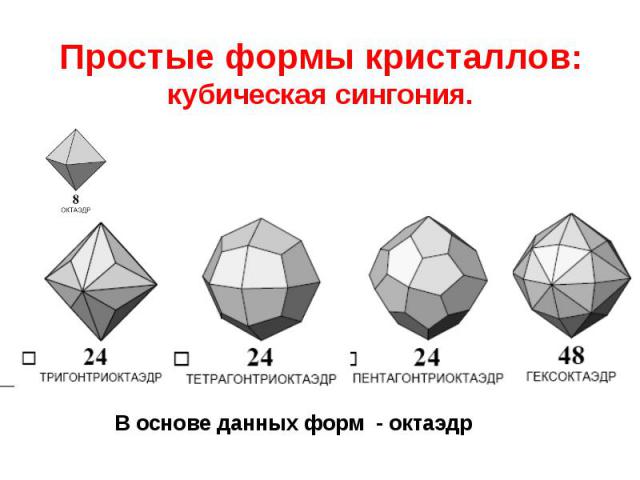
Простые формы кристаллов: кубическая сингония.

Комбинации простых форм

Форма реальных кристаллов

Монокристаллы

Кристаллические агрегаты: друзы кристаллов

Кристаллические агрегаты: параллельные сростки кристаллов

Кристаллические агрегаты: двойники

Кристаллические агрегаты:

Кристаллические агрегаты: эпитаксия

Кристаллические агрегаты: дендриты и скелетные кристаллы

Кристаллические агрегаты: дендриты и скелетные кристаллы

Кристаллические агрегаты: дендриты и скелетные кристаллы
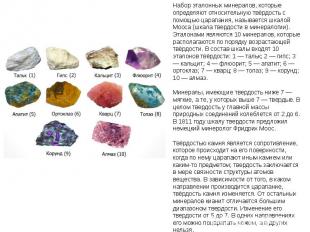
















Курс «Общая геология». Лекция 1 Геология как наука, её значение и место среди других наук

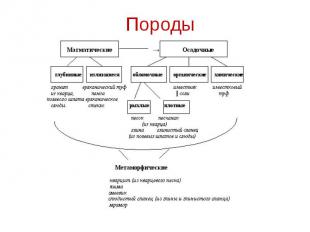
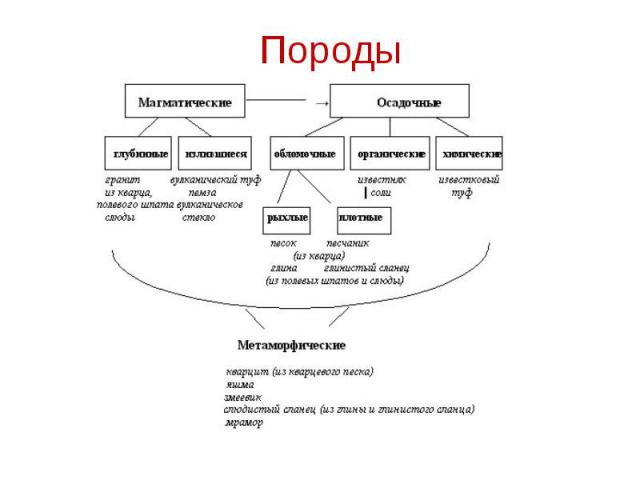
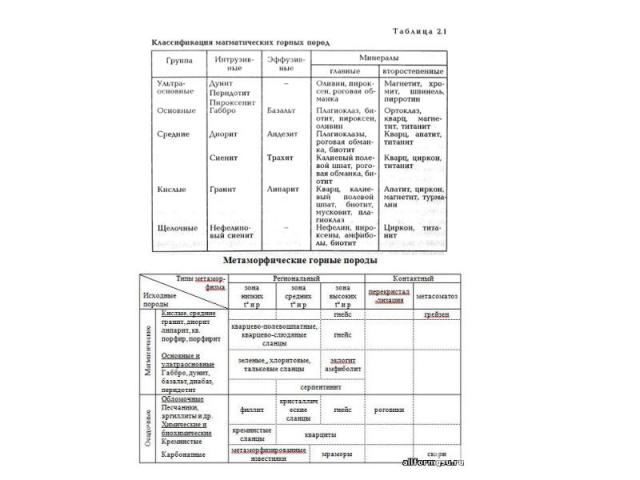
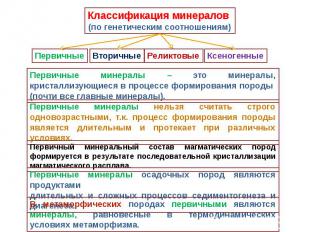
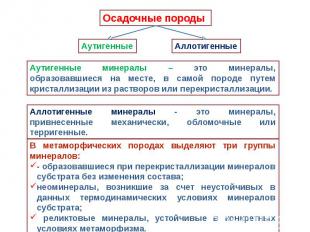
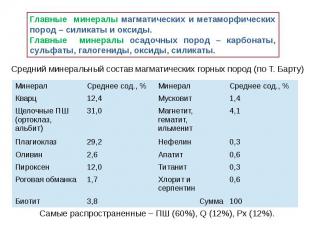
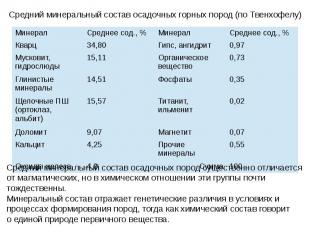
Породы


Вторичные минералы Образованы в результате глубокого химического преобразования первичных, или же синтезированных непосредственно в почве. Особенно важна среди них роль глинистых минералов — каолинит, монтморилонит, галлаузит, серпентенит Высоко содержание минералов-оксидов и гидроксидов железа (лимонит, гематит), марганца (вернадит, пиралюзит, мангатит), алюминия (гиббсит) и др., также сильно влияющие на свойства почвы — они участвуют в формировании структуры, почвенного поглощающего комплекса (особенно в сильно выветрелых тропических почвах), принимают участие в окислительно-восстановительных процессах. Большую роль в почвах играют карбонаты (кальцит, арагонит). В аридных регионах в почве нередко накапливаются легкорастворимые соли (хлорид натрия, карбонат натрия и др.), влияющие на весь ход почвообразовательного процесса.