Презентация на тему: МИНЕРАЛОГИЯ

Минералогия Краткий курс семинарских занятий


В самородном состоянии в земной коре устанавливается свыше 30 химических элементов, главным образом металлов. Сюда же относятся ряд газов и редко встречающиеся элементы в жидком состоянии (ртуть, некоторые амальгамы). Общее весовое значение самородных элементов в земной коре не превышает 0,1% всей массы земной коры). Из этого количества на долю азота приходится около 0,04%, кислорода - 0,01-0,02%. Все остальные элементы, встречающиеся в самородном виде, составляют не больше 0,05%. Из них в наибольших относительных количествах представлены: водород, аргон, гелий, углерод, сера, золото, элементы платиновой группы, медь и висмут.
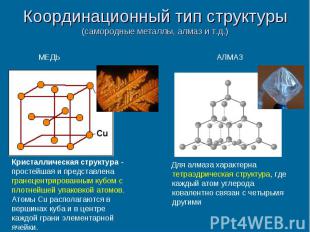
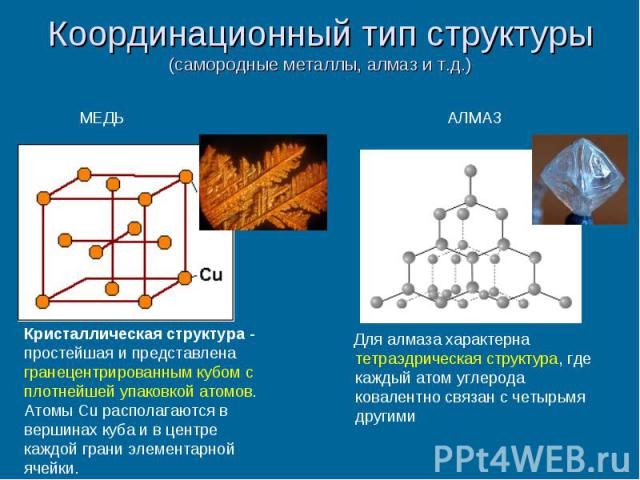
Координационный тип структуры (самородные металлы, алмаз и т.д.) Для алмаза характерна тетраэдрическая структура, где каждый атом углерода ковалентно связан с четырьмя другими

Слоистый тип структуры (графит)

Цепочечно-кольцевой тип структуры (сера) Ромбическая сера обладает редкой для неорганических соединений молекулярной, и притом очень сложной, решеткой. В кристаллической структуре каждый атом серы с двух сторон имеет сферы, пересекающиеся со сферами соседних атомов, причем цепочки, состоящие из 8 атомов, замкнуты в виде зигзагообразно "сморщенного" кольца. Отсюда видно, что молекула серы S8. Расстояние между

Тип сульфиды, сульфосоли и им подобные соединения

К рассматриваемому разделу относятся следующие соединения металлов: Сернистые (сульфиды и сульфосоли), селенистые, теллуристые, мышьяковистые сурьмянистые Соединения с S играют существенную роль в составе многочисленных месторождений металлических полезных ископаемых. Общее весовое количество сернистых соединений, по приблизительному подсчету В. И. Вернадского, составляет максимум 0,15% (к весу земной коры) Главенствующее значение в этих соединениях имеет Fe. Сернистые соединения всех остальных элементов, не считая сероводорода, в весовом отношении в земной коре составляют ничтожный процент (около 0,001%). Типичные соединения с серой образуют: Zn, Pb, Сu, Ag, Sb, Bi, Ni, Co, Mo и Hg.

Общее количество химических элементов, дающих в том или ином виде соединения с серой, достигает 40. Общее количество химических элементов, дающих в том или ином виде соединения с серой, достигает 40. Главнейшие из них следующие: Н, V, Мn, Fe, Ni, Со, Сu, Zn, (Ga), Ge, As, Mo, Ru, (Rh), (Pd), Ag, Cd, (In), Sn, Sb (Re), (Os), (Ir), Pt, Hg, Tl, Pb и Bi. В скобках показаны элементы, не дающие самостоятельных сернистых соединений, а встречающиеся лишь в виде изоморфных примесей. Селенистые соединения (селениды) известны для: Н, Сu, Ag, Hg, Pb и Bi. Кроме того, селен нередко присутствует в сернистых соединениях в виде изоморфной примеси к сере. Теллуристые соединения (теллуриды) по сравнению с селенидами пользуются в природе более широким распространением: Сu, Ag, Au, Hg, Pb, Bi, Ni, Pt. Все они образуют самостоятельные минералы. Мышьяковистые простые соединения (арсениды) установлены для: Fe, Ni, Со и Pt. Более широко распространены сложные соединения в виде сульфосолей-сульфоарсенитов, главным образом для следующих металлов: Сu, Ag и Pb. Сурьмянистые простые соединения (антимониды) известны лишь для Ni. Зато часто устанавливаются сложные соединения - сульфоантимониты Сu, Ag и Pb. Висмутистые простые соединения в природе не известны. Наблюдаются лишь сульфовисмутиты Сu, Ag и Pb.

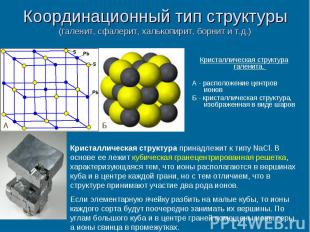
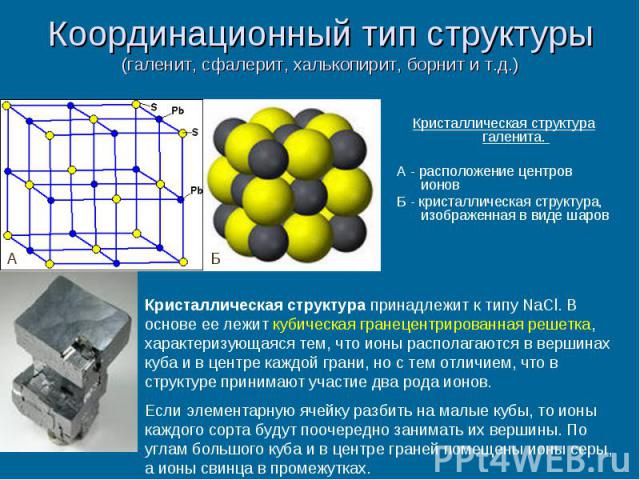
Координационный тип структуры (галенит, сфалерит, халькопирит, борнит и т.д.) Кристаллическая структура галенита. А - расположение центров ионов Б - кристаллическая структура, изображенная в виде шаров

«Дефектный» тип структуры (пирротин) Кристаллическая структура имеет плотнейшую гексагональную упаковку из атомов S. Структура дефектна, т.к. не все октаэдрические пустоты заняты Fe, в силу чего часть Fe2+ перешла в Fe3+. Структурный дефицит Fe в пирротине различен: даёт составы от Fe0,875S (Fe7S8) до FeS (стехиометрический состав FeS — троилит). В зависимости от дефицита Fe меняются параметры и симметрия кристаллической ячейки, и при x~ 0,11 и ниже (до 0,2) пирротин из гексагональной модификации переходит в моноклинную.

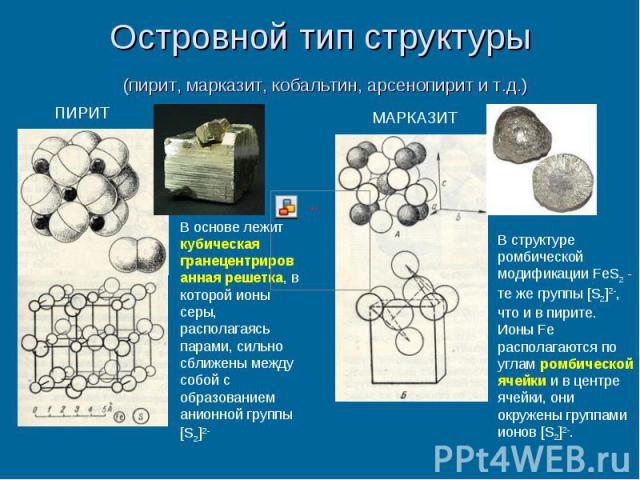
Островной тип структуры (пирит, марказит, кобальтин, арсенопирит и т.д.)

Ленточный (цепочечный) тип структуры (антимонит, буланжерит, киноварь и т.д.)

Слоистый тип структуры (молибденит, аурипигмент и т.д.) Листы ионов Мо располагаются между двумя листами ионов S. Ионы в листах соединены сильными связями, но силы сцепления между "тройными" листами резко ослаблены, чем и обусловлена совершенная спайность кристаллов. Нагляднее можно представить в виде чередующихся тригональных слоев призм с ионами Мо в центрах с пустыми слоями из октаэдров.


Класс окислов и гидроокислов Среднее весовое содержание кислорода в земной коре составляет 49,13% В простейшие соединения с кислородом в том или ином виде входит около 40 элементов Общее весовое количество свободных окислов в литосфере (за исключением гидросферы и атмосферы) составляет около 17%. Из них на долю одного только кремнезема SiO2 приходится 12,6%. Окислы и гидроокислы железа составляют 3,9%. Из остальных наибольшее значение имеют окислы и гидроокислы Al, Mn, Ti и Cr. Все относящиеся к настоящему разделу минералы принято делить на: безводные окислы гидроокислы или окислы, содержащие гидроксил и водородные ионы.



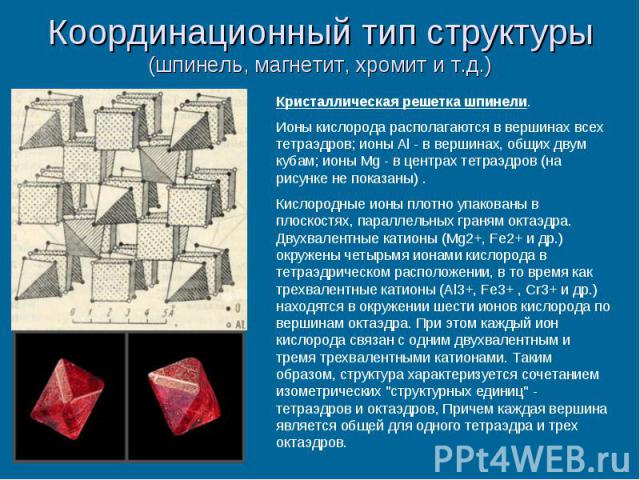
Координационный тип структуры (шпинель, магнетит, хромит и т.д.)

Каркасный тип структуры (кварц)

Полиморфные модификации SiO2

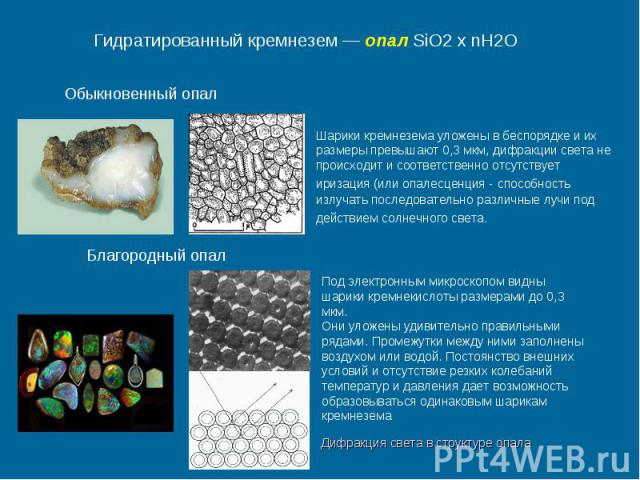
Гидратированный кремнезем — опал SiO2 х nH2O

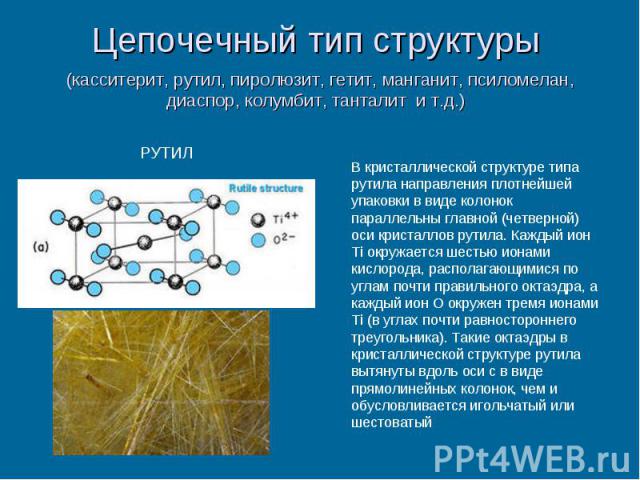
Цепочечный тип структуры (касситерит, рутил, пиролюзит, гетит, манганит, псиломелан, диаспор, колумбит, танталит и т.д.)

Слоистый тип структуры (лепидокрокит, бемит, гидраргиллит, брусит и т.д.) В качестве аниона участвует дипольная гидроксильная группа [ОН]1- с радиусом иона 1,40 Å. В кристаллической структуре эти группы уложены по принципу плотнейшей гексагональной упаковки. Каждый слой состоит из двух плоских листов, сложенных ионами гидроксила параллельно плоскости (0001). Между этими листами лежит лист из катионов Mg2+. Последние занимают все октаэдрические пустоты между двумя листами ОН, т. е. каждый ион Mg располагается между шестью гидроксильными анионами, будучи связан с тремя ионами [ОН]1- одного листа и тремя ионами [ОН]1-другого листа.
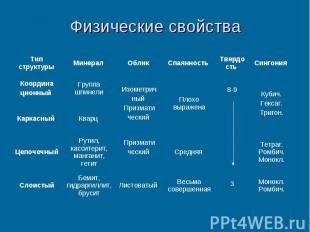
Физические свойства

Класс карбонатов






















ььь



















![Слоистый тип структуры (лепидокрокит, бемит, гидраргиллит, брусит и т.д.) В качестве аниона участвует дипольная гидроксильная группа [ОН]1- с радиусом иона 1,40 Å. В кристаллической структуре эти группы уложены по принципу плотнейшей гексагональной … Слоистый тип структуры (лепидокрокит, бемит, гидраргиллит, брусит и т.д.) В качестве аниона участвует дипольная гидроксильная группа [ОН]1- с радиусом иона 1,40 Å. В кристаллической структуре эти группы уложены по принципу плотнейшей гексагональной …](https://fs1.ppt4web.ru/images/95239/124822/640/img24.jpg)



































