Презентация на тему: Строение атома Опыты Резерфорда

Строение атома Опыты Резерфорда Подготовили ученицы 9 «В» класса: Тишкова Наталья Горшкова Арина Павлова Ольга Никитина Светлана

Конкретные представления о строении атома развивались по мере накопления физикой фактов о свойствах вещества. 1897 г - Дж. Дж. Томсон доказал существование электрона, измерил его заряд и массу. 1897 г - В. Вебер впервые высказал мысль об электронном строении атома ( электроны входят в состав атома). 1905 г - Ф. Линдеман утверждал, что атом кислорода имеет форму кольца, а атом серы- форму лепешки. 1903-1904 гг - Дж. Дж. Томсон предложил модель атома в виде положительно заряженного шара, в котором «плавают» электроны.

Модель строения атома Томсона Моде ль То мсона (иногда называемая «пу динговая модель а тома») — модель атома, предложенная в 1904 году Дж.Дж.Томсоном. После открытия им в 1897 году электрона, Томсон предположил, что отрицательно заряженные «корпускулы» входят в состав атома и предложил модель атома, в котором в облаке положительного заряда, равного размеру атома, содержатся маленькие, отрицательно заряженные «корпускулы», суммарный электрический заряд которых равен заряду положительно заряженного облака, обеспечивая электронейтральность атомов.

Модель Томсона нуждалась в экспериментальной проверке. Важно было убедиться, действительно ли положительный заряд распределён по всему объёму атома с постоянной плотностью. В 1909г. Эрнест Резерфорд совместно со своими сотрудниками Г. Гейгером и Э. Марсденом провёл ряд опытов по исследованию состава и строения атомов.

Английский физик Эрнест Резерфорд родился в Новой Зеландии. В 1894 г. Резерфорду была присуждена степень бакалавра естественных наук. В 1899 г. открыл альфа - и бета-лучи. Вместе с Ф. Содди в 1903 г. разработал теорию радиоактивного распада и установил закон радиоактивных превращений. В 1908 г. ему была присуждена Нобелевская премия.
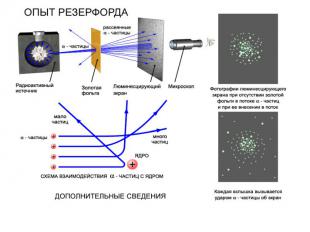

Опыты показали: Подавляющая часть альфа-частиц проходит сквозь фольгу практически без отклонения или с отклонением на малые углы; Некоторая небольшая часть альфа-частиц при прохождении через фольгу отклоняется на значительные углы ( 90,120,150 градусов);

Положительный заряд сосредоточен в малой части атома – ядре; Практически вся масса атома сосредоточена в этом ядре; Отклонения альфа-частиц на большие углы происходят в результате столкновения альфа – частиц с ядром одного из атомов; Теоретические расчеты позволили оценить размеры ядер атомов – порядка 10-14 м, тогда как размеры атома в 10 000 раз больше.

На основе выводов из опытов Резерфордом была предложена планетарная модель атома Планета представляет из себя ядро атома. А вокруг ядра на довольно большом расстоянии вращаются электроны, как и вокруг планеты вращаются спутники. Только скорость вращения электронов в сотни тысяч раз превосходит скорость вращения самого быстрого спутника. Поэтому при своем вращении электрон создает как бы облако над поверхностью ядра. И существующие заряды электронов отталкивают такие же заряды, образованные другими электронами вокруг других ядер. Поэтому атомы не «слипаются», а располагаются на некотором расстоянии друг от друга.
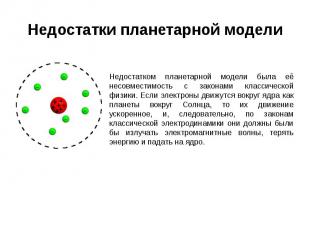
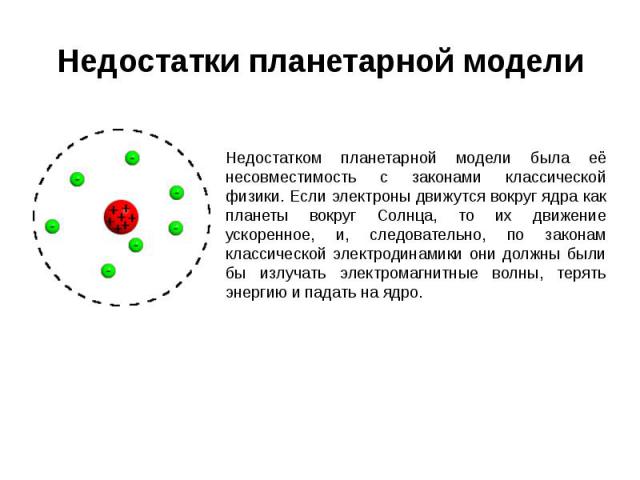
Недостатки планетарной модели Недостатком планетарной модели была её несовместимость с законами классической физики. Если электроны движутся вокруг ядра как планеты вокруг Солнца, то их движение ускоренное, и, следовательно, по законам классической электродинамики они должны были бы излучать электромагнитные волны, терять энергию и падать на ядро.