Презентация на тему: Применение нанопористых оксидных пленок (наноматериалов)

Применение нанопористых оксидных пленок (наноматериалов) - Нанокомпозиционные серебросодержащие материалыиспользуются в медицине как бактерецидные покрытия. Их отличие от аналогов (УФ излучателей, озонаторов): не потребляют энергию устойчивы к воздействию среды(t0,влажность) работают в присутствии человека экологически безопасны, нетоксичны низкая стоимость КарельскаяГосударственнаяПедагогическаяАкадемия( НИЛ «ФИСОПП»доктор физ.- мат. наукЯковлева Н. М. ) Поперечный разрез пленки анодированного оксида алюминия

Электрический ток в электролитах Задачи урока: познакомиться с явлением электролиза и его практическим применением- знать основные понятия по теме и законы электролиза уметь работать в группе, вести диалог, быть терпимым к другому мнению- использовать разные источники информации овладевать исследовательскими навыками, навыками самооценки

Групповой эксперимент «электролиты»Электролитическая диссоциацияМеханизм проводимостиЭлектролизОбобщенный закон электролизаПрименение электролиза (защита плаката)

Тихо- идет эксперимент! Электрическая схема опыта

Запиши результаты эксперимента: 1) Сухой Сu SO4 – не проводит2) Раствор Cu SO4 – проводит3) Сухой Nа Сl – не проводит4) Раствор Nа Сl – проводитДистиллированная вода – не проводитРаствор лимонной кислоты – проводитКритерий оценки: + справились, - не справились

Электролиты – вещества, растворы и расплавы которых проводят электрический токПримеры: р-ры солей р-ры кислот р-ры оснований

Что происходит с хлоридом натрия в воде? диполь- полярная молекула воды
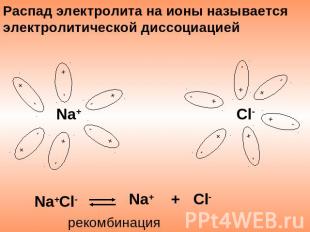
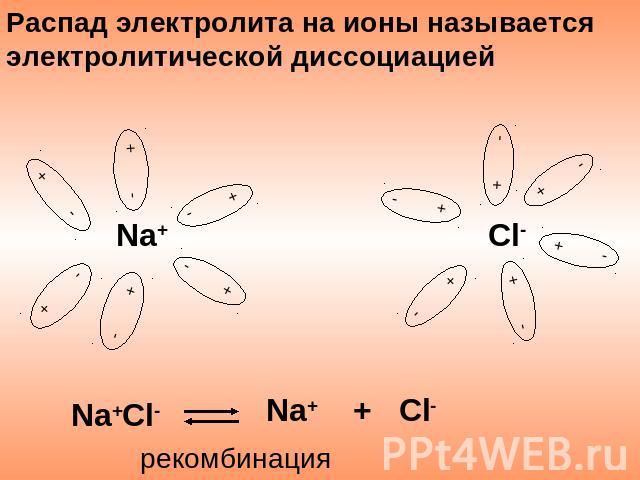
Распад электролита на ионы называется электролитической диссоциацией Na+ + Cl- Na+Cl- рекомбинация

Проверь себя:Диссоциация медного купороса (сульфата меди) СuSO4 Cu2+ + SO42-
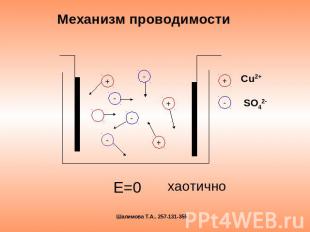
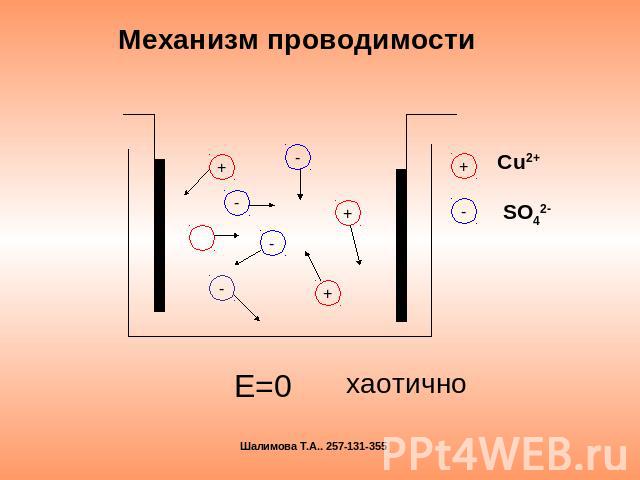
Механизм проводимости Е=0 хаотично
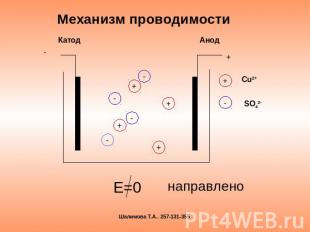
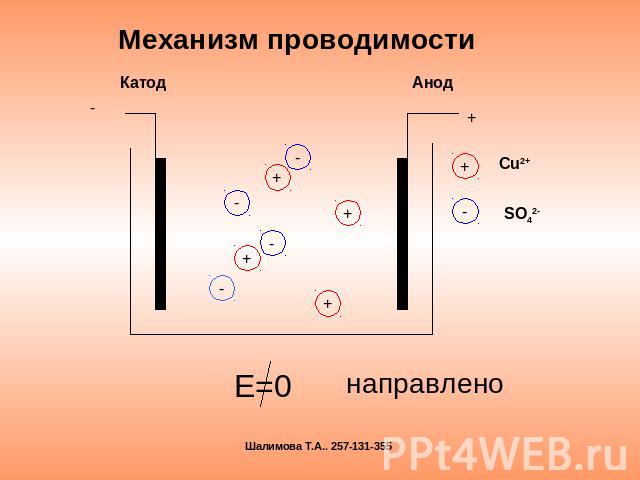
Механизм проводимости Е=0 направлено

Электрический ток в электролите- это направленное движение положительных и отрицательных ионов
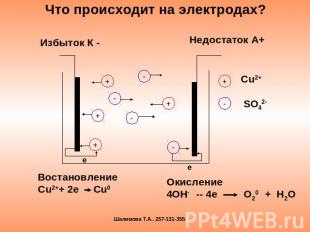
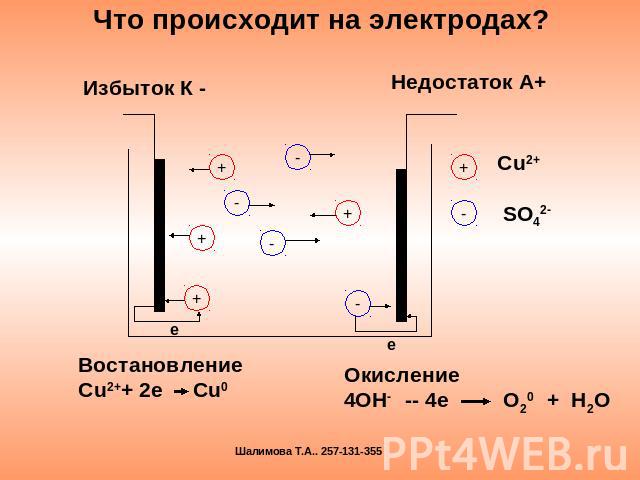
Что происходит на электродах? Избыток К - Недостаток А+ ВостановлениеСu2++ 2e Cu0 Окисление4OH- -- 4e O20 + H2O

Окислительно – восстановительные процессы под действием электрического тока называются электролизом

Вспомни уроки химии и допишисхему электролизаР-р CuSO4 Cu2+ + SO42- H2O H+ + OH- К(-) А(+)

Правила электролизаK Ca Na Mg Al Zn Cr Fe H Cu Hg Ag An PtK:Металлы после H – 100% восстанавливаютсяМеталлы от Al до H частично восстанавливаются +H2O восстанавливается3. Металлы от K до Al – не восстанавливаются восст H2O: 2 H2O + 2e H20 + 2 OH– A:Cl, Br, F окисляетсяCO3–2, SO4– 2, PO4– 2 – не окисляются (окисляется H2O) окисл H2O: 4 OH– – 4 e O20 + 2 H2O

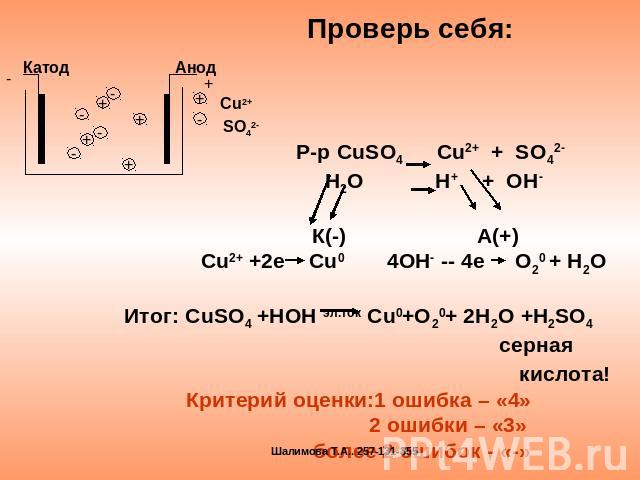
Проверь себя: Р-р CuSO4 Cu2+ + SO42- H2O H+ + OH- К(-) А(+) Сu2+ +2e Cu0 4OH- -- 4e O20 + H2OИтог: СuSO4 +HOH эл.ток Сu0+O20+ 2H2O +H2SO4 cерная кислота!Критерий оценки:1 ошибка – «4» 2 ошибки – «3» более 2 ошибок - «-»

Закон электролиза был экспериментально установлен М.Фарадеем в 1832году. Английский физик Майкл Фарадей родился в предместье Лондона в семье кузнеца. Окончив начальную школу, с двенадцати лет он работал разносчиком газет, а в 1804 г. поступил в ученики к переплетчику Рибо, всячески поощрявшем стремление Фарадея к самообразованию. Фарадея влекли главным образом естественные науки – химия и физика. В 1813 г. один из заказчиков подарил Фарадею пригласительные билеты на лекции Гемфри Дэви в Королевском институте, сыгравшие решающую роль в судьбе юноши. Фарадей с помощью Дэви получил место лабораторного ассистента в Королевскоминституте.

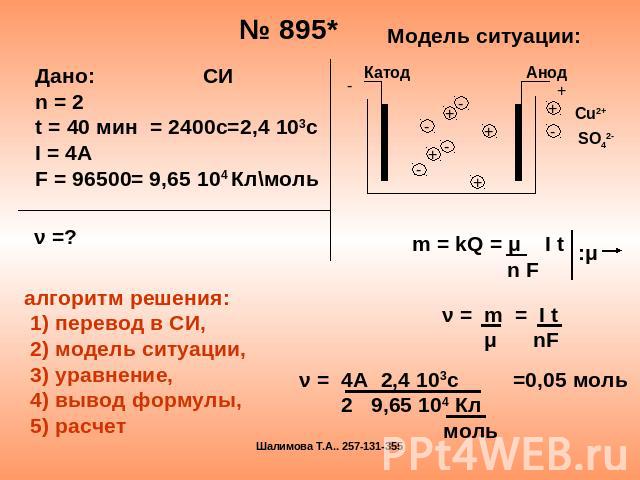
Обобщенный закон электролиза: m= kQ m= μ I t Fn Масса вещества, выделившегося на электроде, пропорциональна общему заряду, прошедшему через электролит K – электрохимический эквивалент (таб. 10 Рымкевич)Q –общий заряд Клμ – молярная масса кг/мольn- валентностьF= 96500 Кл/моль- постоянная ФарадеяF= Nae=?Na=6 10 23 1/моль-число Авагадрое=1,6 10-19 Кл- заряд электрона


Дано: СИn = 2t = 40 мин = 2400с=2,4 103сI = 4AF = 96500= 9,65 104 Кл\моль алгоритм решения: 1) перевод в СИ, 2) модель ситуации, 3) уравнение, 4) вывод формулы, 5) расчет m = kQ = μ I t n F ν = m = I t μ nF ν = 4А 2,4 103с =0,05 моль 2 9,65 104 Кл моль

Проверь себя: I в Дано Си Решение m = 1,8 г = 1,8 10–3 кг m = k I t I = 2A m k = 0,3 10–6 кг/кл t = kI t = ? t = 3 103с = = 50( мин) критерий оценки задач «5» -выполнены все пункты алгоритма «4» - выполнены четыре пункта алгоритма «3» – выполнены три пункта алгоритма «минус» - не справился

II в Дано Си Решение t = 20 мин = 1,2 103 с m = k I t I = 0,5 A m m1 = 70,4 10–3 кг k = I t = m2 = 70,58 10–3 кг m2 – m1 k = ? = I t = = 0,3 10–6 (кг/кл)
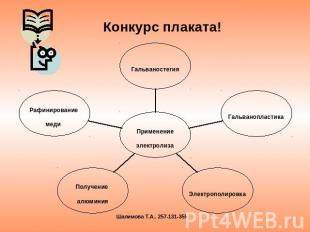
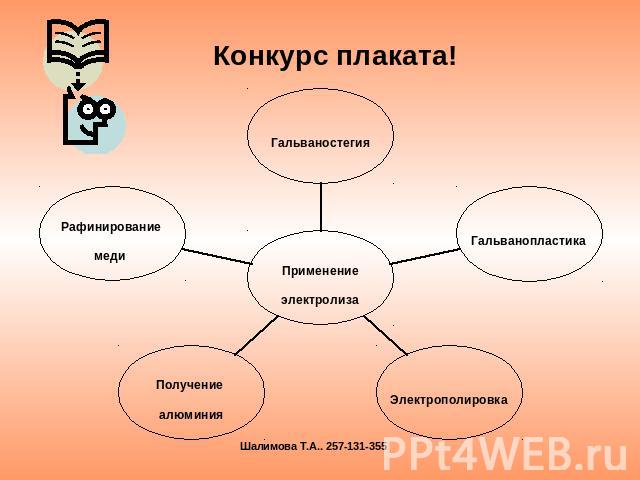
Конкурс плаката!
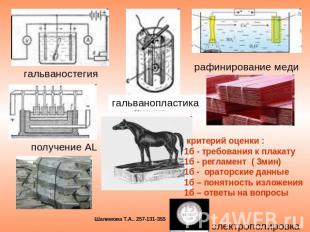
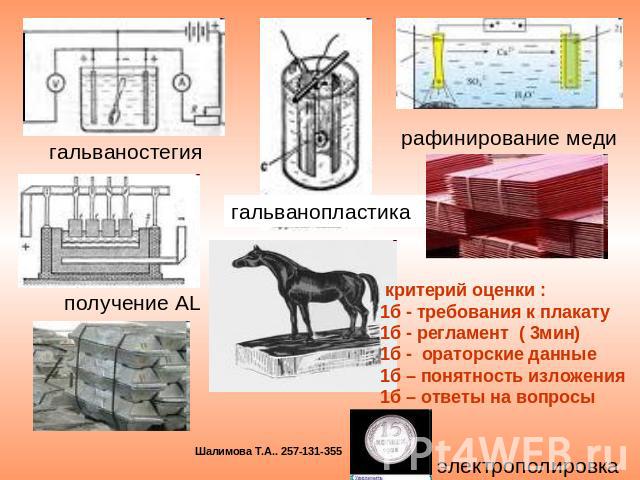
гальваностегия получение AL гальванопластика рафинирование меди критерий оценки :1б - требования к плакату 1б - регламент ( 3мин)1б - ораторские данные1б – понятность изложения 1б – ответы на вопросы

Д/з-выучить определения:ЭлектролитыДипольЭлектролитическая диссоциацияРекомбинацияИонЭлектролизКатодАнодВосстановлениеОкисление-анализ формул- законов электролиза-задачи по желанию Удачи! Критерий оценки урока:5 - все понял, могу сейчас повторить 4 - в целом понял, могу ответить на вопросы 3 - понял лишь часть материала «минус» - ничего не понял

Использовались: - Капустин Н. П. Педагогические технологии адаптивной школы издательский центр «Академия» 2002г- О.В.Акулова и др. Конструирование ситуационных задач для оценки компетентности учащихся- журнал «химия в школе» № ? 199?г- youtube. com опыты по электролизу- Шахмаев Н.М.и др. Элементарный курс физики - Алексеева М.Н. Физика юным - Ходаков Ю.В. и др. Неорганическая химия 9- физика 10 под ред. Пинского А.А.Шахмаев Н.М. физика 10 Яковлева Н.М. выступление на конференции «Шаг в будущее»

Содержание презентации:1. Актуализация знаний (слайд 1)2. Тема и задачи урока (слайд 2)3. План урока (слайд 3)4. Групповой эксперимент (слайды 4 - 6)5. Электролитическая диссоциация (слайды 7 - 9)6. Механизм проводимости (слайды 10 – 13)7. Электролиз ( слайды 14 – 18)8. Обобщенный закон электролиза ( слайды 19 – 20)9. Решение задач на закон электролиза (слайды 21 – 23)Применение электролиза ( защита плаката по своим слайдам)Д\з, рефлексия (слайд 26)Использовались (слайд 27)