Презентация на тему: Изменение агрегатных состояний вещества

Агрегатные превращения вещества. 900igr.net
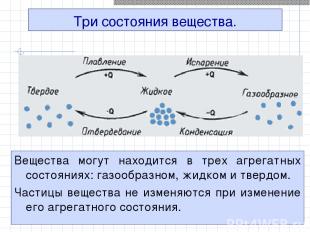
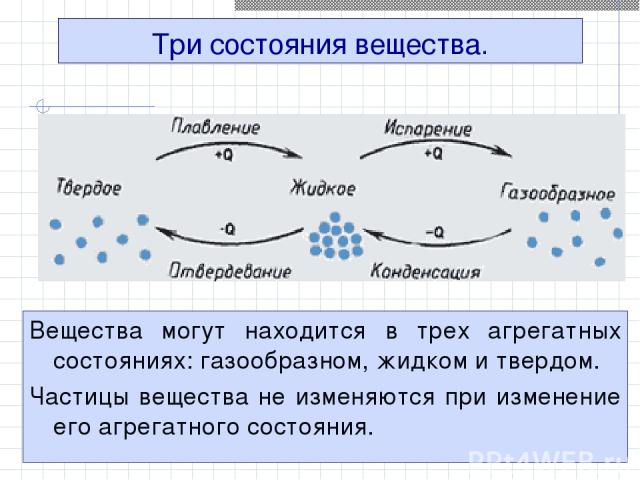
Три состояния вещества. Вещества могут находится в трех агрегатных состояниях: газообразном, жидком и твердом. Частицы вещества не изменяются при изменение его агрегатного состояния.
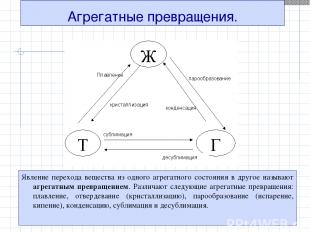
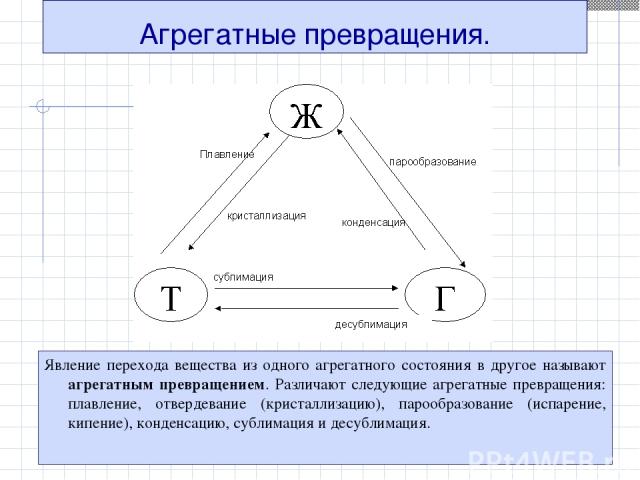
Агрегатные превращения. Явление перехода вещества из одного агрегатного состояния в другое называют агрегатным превращением. Различают следующие агрегатные превращения: плавление, отвердевание (кристаллизацию), парообразование (испарение, кипение), конденсацию, сублимация и десублимация.
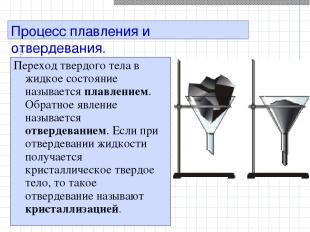
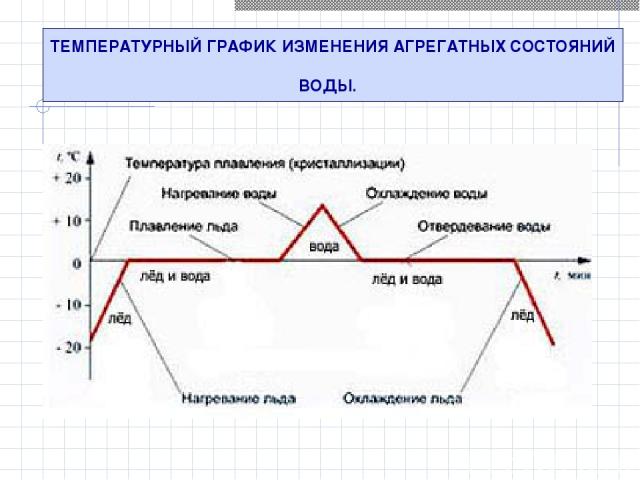
Процесс плавления и отвердевания. Переход твердого тела в жидкое состояние называется плавлением. Обратное явление называется отвердеванием. Если при отвердевании жидкости получается кристаллическое твердое тело, то такое отвердевание называют кристаллизацией.
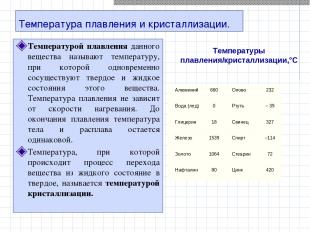
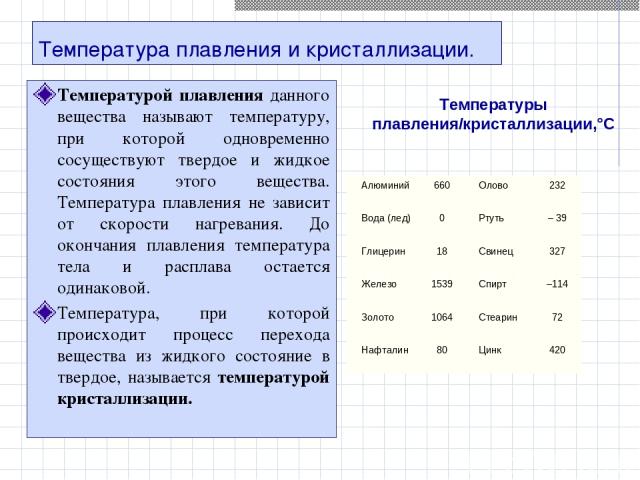
Температура плавления и кристаллизации. Температурой плавления данного вещества называют температуру, при которой одновременно сосуществуют твердое и жидкое состояния этого вещества. Температура плавления не зависит от скорости нагревания. До окончания плавления температура тела и расплава остается одинаковой. Температура, при которой происходит процесс перехода вещества из жидкого состояние в твердое, называется температурой кристаллизации.
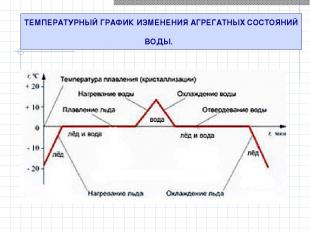
ТЕМПЕРАТУРНЫЙ ГРАФИК ИЗМЕНЕНИЯ АГРЕГАТНЫХ СОСТОЯНИЙ ВОДЫ.

Расчет количества теплоты при плавлении(кристаллизации) Количество теплоты, поглощаемое (выделяющееся) при плавлении (кристаллизации), пропорционально массе расплавившегося (выкристаллизовавшегося) вещества. Коэффициентом пропорциональности служит удельная теплота плавления данного вещества. Удельная теплота плавления – физическая величина, показывающая количество теплоты, необходимое для плавления 1 кг кристаллического вещества, предварительно нагретого до температуры плавления. Единица измерения – 1 Дж/кг. При кристаллизации расплава всегда выделяется такое же количество теплоты, которое было затрачено на его образование. Q = λ m

Объяснение процесса плавления. Жидкому состоянию вещества по сравнению с твердым кристаллическим присущи : большая скорость движения молекул; большее расстояние между молекулами; отсутствие строгого расположение молекул. Поэтому для превращения твердого тела в жидкость его молекулам необходимо сообщить дополнительную энергию. Жидкому состоянию соответствует большая внутренняя энергия.

Парообразование Переход вещества из жидкого состояния в газообразное Испарение – парообразование, происходящее с поверхности жидкости при любой температуре Кипение-парообразование, происходящее по всему объему жидкости при температуре кипения
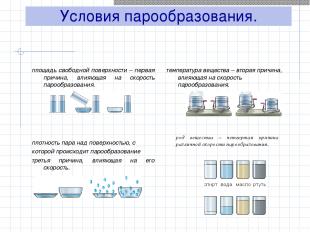
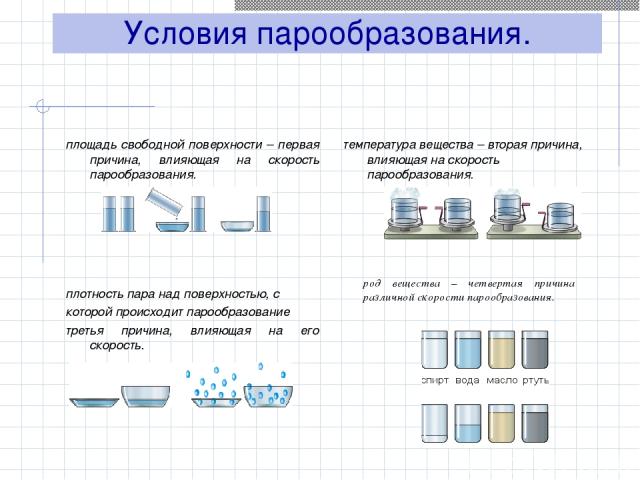
Условия парообразования. площадь свободной поверхности – первая причина, влияющая на скорость парообразования. температура вещества – вторая причина, влияющая на скорость парообразования. плотность пара над поверхностью, с которой происходит парообразование третья причина, влияющая на его скорость. род вещества – четвертая причина различной скорости парообразования.

Кипение. Парообразование, происходящее по всему объему жидкости вследствие возникновения и всплытия на поверхность многочисленных пузырей насыщенного пара, называется кипением. Кипение происходит с поглощением теплоты. Большая часть подводимой теплоты расходуется на разрыв связей между частицами вещества, остальная часть - на работу, совершаемую при расширении пара. В результате энергия взаимодействия между частицами пара становится больше, чем между частицами жидкости, поэтому внутренняя энергия пара больше, чем внутренняя энергия жидкости при той же температуре.

Удельная теплота парообразования. Количество теплоты, необходимое для перевода жидкости в пар в процессе кипения можно рассчитать по формуле: где m - масса жидкости (кг), L - удельная теплота парообразования. Удельная теплота парообразования показывает, какое количество теплоты необходимо, чтобы превратитъ в пар 1 кг данного вещества при температуре кипения. Единица удельной теплоты парообразования в системе СИ: [ L ] = 1 Дж/ кг

Температура кипения. Во время кипения температура жидкости не меняется.. Температура кипения зависит от давления, оказываемого на жидкость. Каждое вещество при одном и том же давлении имеет свою температуру кипения. При увеличением атмосферного давления кипение начинается при более высокой температуре, при уменьшении давления - наоборот.. Так, например, вода кипит при 100 °С лишь при нормальном атмосферном давлении.